
| A. | 只有①③⑤ | B. | 只有②③④ | C. | 只有③④⑤ | D. | ①②③④⑤均有 |
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
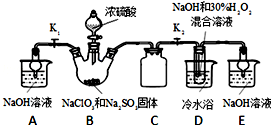
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
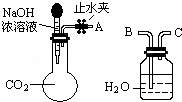 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠原子有强还原性,钠离子有弱氧化性 | |
| B. | 钠离子浓度大的溶液一定显碱性 | |
| C. | 由于钠很活泼,所以一定能从溶液中置换出金属活动性顺序表中钠后面的金属 | |
| D. | 钠是电和热的良导体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com