质子交换膜燃料电池广受关注.
(1)质子交换膜燃料电池中作为燃料的H
2通常来自水煤气.
已知:C(s)+
O
2(g)═CO(g)△H
1=-110.35kJ?mol
-12H
2O(l)═2H
2(g)+O
2(g)△H
2=+571.6kJ?mol
-1H
2O(l)═H
2O(g)△H
3=+44.0kJ?mol
-1则:C(s)+H
2O(g)═CO(g)+H
2(g)△H
4=
.
(2)燃料气(流速为1800mL?h
-1;体积分数为:50% H
2,0.98% CO,1.64% O
2,47.38% N
2)中的CO会使电极催化剂中毒,使用CuO/CeO
2催化剂可使CO优先氧化而脱除.
①160℃、CuO/CeO
2作催化剂时,CO优先氧化反应的化学方程式为
.
②灼烧草酸铈[Ce
2(C
2O
4)
3]制得CeO
2的化学方程式为
.
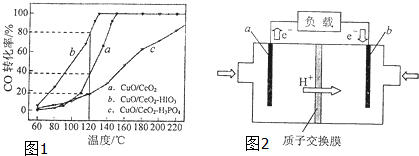
③在CuO/CeO
2催化剂中加入不同的酸(HIO
3或H
3PO
4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示.加入
.(填酸的化学式)的CuO/CeO
2催化剂催化性能最好.催化剂为CuO/CeO
2-HIO
3,120℃时,反应1小时后CO的体积为
mL.
(3)图2为甲酸质子交换膜燃料电池的结构示意图.该装置中
.(填“a”或“b”)为电池的负极,负极的电极反应式为
.




 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案