
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
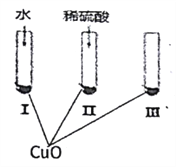
(1)通过实验I可以证明___________________。
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入__________,再加入_________。
(3)探究结果为__________ 。
(4)反应的离子方程式为__________。
【答案】 水不能使氧化铜溶解 可溶性硫酸盐 稀硫酸 H+能溶解氧化铜,而H2O、SO42-两种离子都不能使CuO溶解 CuO+2H+=Cu2++H2O
【解析】(1)实验Ⅰ的试管中的液体成分为水,该实验证明水不溶解CuO;
(2)要想证明起作用的是H+,首先要排除SO42-的干扰,所以在Ⅲ中应该加入可溶性硫酸盐,如Na2SO4(或K2SO4等),最后再加放稀硫酸;
(3)通过对比实验验证起作用的成分,得出结论是:氧化铜固体溶于稀H2SO4是稀硫酸H+在起作用,而H2O、SO42-两种粒子都不能使CuO溶解;
(4)CuO与硫酸电离的氢离子反应生成铜离子和水,反应的离子方程式为:CuO+2H+=Cu2++H2O。
点睛:性质实验方案设计的一般思路、程序是: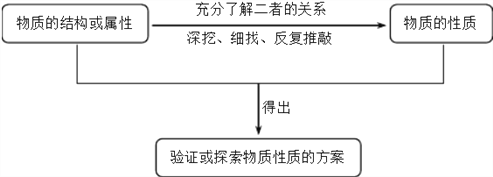 。
。
【题型】实验题
【结束】
28
【题目】(1)己知: 将Cl2通入适量KOH 溶液,产物中可能有KC1、KClO、KC1O3,且c(Cl-):c(C1O-)的值与温度高低有关。当n(KOH)=amol时,若某温度下,反应后c(Cl-):c(C1O-)=11,则溶液中c(ClO-):c(ClO3-)=__________。
(2)在P+CuSO4+H2O→CuP+H3PO4+H2SO4(未配平)的反应中,7.5molCuSO4 可氧化P的物质的量为_______mol。生成1molCu3P时,参加反应的P 的物质的量为_______mol。
(3)一定量的CuS和Cu2S 的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-) 加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO16.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V的极小值为______L。
(4)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol/L 硝酸的溶液100mL,恰好使混合物全部溶解,且放出336mLNO (标准状况下),向所得溶液中加入KSCN 溶液,溶液无红色出现; 若取相同质量的Fe、FeO、Fe3O4的混合物,加入1mol/L 的稀硫酸溶液,也恰好使混合物完全溶解(假设还原产物唯一),反应后向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的的稀硫酸的体积是______mL。
【答案】 1:2 1.5 2.2 11.2 42.5
【解析】(1)若某温度下,反应后 =11,令n(ClO-)=1mol,反应后c(Cl-):c(ClO-)=11,则n(Cl-)=11mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5×n(ClO3-)+1×1mol=1×11mol,解得n(ClO3-)=2mol,则溶液中
=11,令n(ClO-)=1mol,反应后c(Cl-):c(ClO-)=11,则n(Cl-)=11mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即5×n(ClO3-)+1×1mol=1×11mol,解得n(ClO3-)=2mol,则溶液中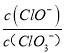 =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(2)根据得失电子守恒配平方程式为11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,该反应中有![]() 的P作还原剂,7.5molCuSO4参加氧化还原反应,被氧化的P的物质的量=
的P作还原剂,7.5molCuSO4参加氧化还原反应,被氧化的P的物质的量=![]() =1.5mol,根据11P---5Cu3P,若生成1molCu3P时,参加反应的P的物质的量=
=1.5mol,根据11P---5Cu3P,若生成1molCu3P时,参加反应的P的物质的量=![]() ×11mol=2.2mol,故答案为:1.5;2.2;
×11mol=2.2mol,故答案为:1.5;2.2;
(3)n(CuO)= ![]() =0.2 mol,若上述气体为NO和NO2的混合物,且体积比为1:1,则转移电子物质的量=
=0.2 mol,若上述气体为NO和NO2的混合物,且体积比为1:1,则转移电子物质的量=![]() ×
×![]() ×(5-2)+
×(5-2)+ ![]() ×
×![]() ×(5-4)=
×(5-4)= ![]() ×2=
×2=![]() mol,若混合物全是CuS,其物质的量n(CuS)= n(CuO)=0.2mol,转移电子物质的量=0.2×(6+2)=1.6 mol,则V=17.92L,若混合物全是Cu2S,其物质的量n(Cu2S)=
mol,若混合物全是CuS,其物质的量n(CuS)= n(CuO)=0.2mol,转移电子物质的量=0.2×(6+2)=1.6 mol,则V=17.92L,若混合物全是Cu2S,其物质的量n(Cu2S)= ![]() n(CuO)=
n(CuO)= ![]() ×0.2mol=0.1mol,转移电子物质的量0.1mol×10=1mol=
×0.2mol=0.1mol,转移电子物质的量0.1mol×10=1mol=![]() mol,解得V=11.2L,则V的极小值为11.2L,故答案为:11.2;
mol,解得V=11.2L,则V的极小值为11.2L,故答案为:11.2;
(4)向一定量的Fe、FeO、Fe3O4混合物,加入1molL-1HNO3溶液,恰好使混合物全部溶解,且放出336mLNO(标准状况下),向所得溶液中加入KSCN溶液,溶液无红色出现,说明生成Fe(NO3)2,生成的NO为![]() =0.015mol,由N元素守恒可知生成的Fe(NO3)2为
=0.015mol,由N元素守恒可知生成的Fe(NO3)2为![]() ×(0.1mol-0.015mol)=0.0425mol;向一定量的Fe、FeO、Fe3O4的混合物中,加入1molL-1硫酸的溶液,也恰好使混合物全部溶解,向所得溶液中加入KSCN溶液,溶液无红色出现,说明溶液中溶质为FeSO4,由Fe元素守恒可知n(FeSO4)=0.0425mol,则硫酸的物质的量为0.0425mol,硫酸的物质的量浓度为
×(0.1mol-0.015mol)=0.0425mol;向一定量的Fe、FeO、Fe3O4的混合物中,加入1molL-1硫酸的溶液,也恰好使混合物全部溶解,向所得溶液中加入KSCN溶液,溶液无红色出现,说明溶液中溶质为FeSO4,由Fe元素守恒可知n(FeSO4)=0.0425mol,则硫酸的物质的量为0.0425mol,硫酸的物质的量浓度为![]() =0.0425L=42.5mL,故答案为:42.5。
=0.0425L=42.5mL,故答案为:42.5。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒,其中N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )

A. 该反应的还原剂是Cl-
B. 反应后溶液的酸性明显增强
C. 消耗1mol还原剂,转移6mol电子
D. 氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“雾霾”成为人们越来越关心的环境问题.雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质.请回答下列问题:
(1)汽车尾气是雾霾形成的原因之一.尾气治理可用汽油中挥发出来的烃类物质 (CxHy)催化还原尾气中的NO气体,该过程的化学方程式为 .
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一.经研究发现将煤炭在 ![]() 的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为: . 2NO(g)+2CO(g)N2(g)+2CO2 (g)△H
的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为: . 2NO(g)+2CO(g)N2(g)+2CO2 (g)△H
已知:
①N2(g)+O2(g)2NO(g)△H1=+180.5kJmol﹣1
②2CO(g)2C(s)+O2(g)△H2=+221kJmol﹣1
③C(s)+O2(g)CO2(g)△H3=﹣393.5kJmol﹣1
则△H=
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨. 
①a表示离子交换膜(填“阴”或“阳”).A﹣E分别代表生产中的原料或产品.其中C为硫酸,则A表示 . E表示 .
②阳极的电极反应式为 .
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的 反应为:2SO2(g)+O2(g)2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2):n(O2)=2:1],测得容器内总压强与反应时间如图二所示.
①图中A点时,SO2的转化率为 .
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,刻C点的正反应
速率vc(正)与A点的逆反应速率vc (逆)的大小关系为vc(正)vc (逆) (填“>”、“<”或“=”)
③图中B点的压强平衡常数kp=(用平衡分压代替平衡浓度计算.分压=总压×物质的量分数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和食盐水溶液;②75%的乙醇溶液;③单质溴和氯化钠的水溶液。分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 蒸馏、萃取、分液 D. 分液、蒸馏、萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应的中和热为 , 表示该中和热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,投入4molSO2和4mol氧气,到2L的密闭容器中,反应达到平衡时n(SO2)+n(O2)=n(SO3),求二氧化硫的转化率和此温度下的平衡常数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象的叙述,不正确的是( )
A. 氢气在氯气中燃烧,发出苍白色火焰
B. 铁丝在氯气中燃烧,生成红棕色烟
C. 钠在氯气中燃烧,生成白色的烟
D. 铜丝在氯气中燃烧,生成蓝色的烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.
如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com