
����Ŀ��Ħ����[(NH4)2Fe(SO4)2��6H2O]��һ����Ҫ�Ļ���ԭ�ϣ���������ȡ����Fe3O4�Ͳ��������ص���
��1��ȡһ������Ħ������Ʒ�����NaOH��Һ��Ӧ��
�ٸ�������������������õ�Ħ���εĴ���С��ʵ��ֵ����ԭ����______��
��������Fe(OH)2�����м���NaNO2��Һ���Ƶ�����Fe3O4��ͬʱ����NO���÷�Ӧ�����ӷ���ʽΪ______��
��2��Ħ���ξ���������KOH��H2C2O4��Ӧ�ɵõ����������أ�KaFeb(C2O4)c��dH2O�ݣ�����FeԪ�ػ��ϼ�Ϊ+3��
����֪25 �棬H2C2O4�ĵ��볣��Ka1=5.6��10-2��Ka2=5.4��10-5��pH=4��H2C2O4��Һ��c(C2O![]() ):c(HC2O)=______��
):c(HC2O)=______��
��Ϊ��ȷ�����������ص���ɣ�ȷ��ȡ4.910 g��Ʒ�ڵ��������¼��ȣ�������Ʒ��ʣ���������¶ȵı仯��ͼ��ʾ��
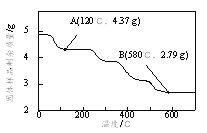
��֪��a��120��ʱ����ȫʧȥ�ᾧˮ��
b��200��~580���ֽ������CO��CO2�ָ�����״�������Ϊ1.008 L��
c��580�����ϲ�������ΪFeO��K2CO3�Ļ���
��������ʵ�����ݼ�������������е�n(Fe3+):n(C2O42-)_____________��д��������̣���
���𰸡� ������������ˮ����Һ���в��ְ���û���ݳ� 3Fe(OH)2+ 2NO��Fe3O4+2NO��+2OH��+2H2O 0.54 ����Ԫ���غ�õ��ֽ����������ΪCO��CO2��n(CO)+n(CO2)=![]() =4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��
=4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��![]() n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[
n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[![]() n(K+)+4.5��10-2 mol]��
n(K+)+4.5��10-2 mol]��![]() ����ã�n(Fe3+)=1��10-2 mol n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3
����ã�n(Fe3+)=1��10-2 mol n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3
��������(1)��Ħ����[(NH4)2Fe(SO4)2��6H2O]���������Ʒ�Ӧ���ɰ�����������������ˮ����Һ���в��ְ���û���ݳ�����˸�������������������õ�Ħ���εĴ���С��ʵ��ֵ���ʴ�Ϊ��������������ˮ����Һ���в��ְ���û���ݳ���
��Fe(OH)2�����м���NaNO2��Һ���Ƶ�����Fe3O4��ͬʱ����NO����Ӧ�����ӷ���ʽΪ3Fe(OH)2+ 2NO2-��Fe3O4+2NO��+2OH��+2H2O���ʴ�Ϊ��3Fe(OH)2+ 2NO2-��Fe3O4+2NO��+2OH��+2H2O��
(2)����֪25 ����H2C2O4�ĵ��볣��Ka1=5.6��10-2��Ka2=5.4��10-5��pH=4��H2C2O4��Һ��![]() =
=![]() =
=![]() =
=![]() =0.54���ʴ�Ϊ��0.54��
=0.54���ʴ�Ϊ��0.54��
�ڸ���Ԫ���غ�õ��ֽ����������ΪCO��CO2��n(CO)+n(CO2)= ![]() =4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��
=4.5��10-2 mol��2n(C2O42-)= n(K2CO3)+ n(CO)+n(CO2)= n(K2CO3)+ 4.5��10-2 mol��n(Fe3+)��72 g��mol-1��![]() n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[
n(K+)��138 g��mol-1=2.79 g�� 3n(Fe3+)+ n(K+)=2��[![]() n(K+)+4.5��10-2 mol]��
n(K+)+4.5��10-2 mol]��![]() ����ã�n(Fe3+)=1��10-2 mol��n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3���ʴ�Ϊ��1:3��
����ã�n(Fe3+)=1��10-2 mol��n(K+)= 3��10-2 mol��n(C2O42-)=3��10-2 mol��n(Fe3+):n(C2O42-)=1��10-2 mol: 3��10-2 mol=1:3���ʴ�Ϊ��1:3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ھ��������˵����ȷ����
A. �κξ�����,�����������Ӿ�һ����������
B. ԭ�Ӿ�����ֻ���й��ۼ�
C. ԭ�Ӿ�����۵�һ���Ƚ�������ĸ�
D. ���Ӿ�����ֻ�������Ӽ�,�����й��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����һ���������ォ��ˮ�е�����[CO(NH2)2]�Ļ�ѧ��ֱ��ת��Ϊ���ܣ������ɶԻ����Ѻ����ʵ�װ�ã�ͬʱ���ô�װ�õĵ��������϶�ͭ������˵������ȷ����
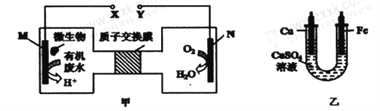
A. ���缫Ӧ��Y������
B. H+�����ӽ���Ĥ���������ƶ�
C. ��N�缫����0.25mol����ʱ�������缫����16g
D. M�缫��Ӧʽ:H2NCONH2+H2O-6e-=CO2��+N2+6H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʷ���������ȷ��һ���ǣ�������
A.Һ���ǻ�����
B.ˮ�����Ǵ�����
C.�ƾ��ǵ����
D.������ڼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. �������NaCl��2Cl����2H2O ![]() 2OH����Cl2����H2��
2OH����Cl2����H2��
B. �ð�ˮ�ܽ�AgCl������Ag+��2NH3��H2O��[Ag(NH3)2]+��2H2O
C. Na2CO3��Һ������������3CO32����Br2��Br����BrO3����3CO2
D. ��������ˮ��Ӧ��2Na��2H2O��2Na+��2OH����H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�Ļ���ԭ�ϣ��ڹ�ҵ�Ͽ��������컯�ʡ�ũҩ��ըҩ��Ⱦ�ϵȡ����й���Ũ�������ʵ���������ȷ����
A.�ѻӷ�B.������ˮC.����̼��ӦD.���백����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ٵ����������̼���������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ��
��1����֪��N2 (g) +O2 (g) =2NO (g) ��H=+180.5kJ��mol-1
C (s) +O2 (g) =CO2 (g) ��H=-393.5 kJ��mol-1
2C (s) +O2(g) =2CO (g) ��H=-221 kJ��mol-1
��ij��Ӧ��ƽ�ⳣ������ʽΪ�� 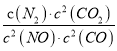 ����д���˷�Ӧ���Ȼ�ѧ����ʽ___________________��
����д���˷�Ӧ���Ȼ�ѧ����ʽ___________________��
��2����CH4����ԭNOx����������Ⱦ��������ӦCH4+2NO2=CO2+2H2O+N2���Ϊԭ��أ�����ڲ��Dz��������Ƶ�����ﯾ��壬���Դ���O2-�����ص�������ӦʽΪ_______��
��3������H2��CO2��һ�������¿��Ժϳ���ϩ��6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)��֪��ͬ�¶ȶ�CO2��ת���ʼ�������Ч��Ӱ����ͼ��ʾ�������й�˵������ȷ����_______������ţ���
CH2=CH2(g)+4H2O(g)��֪��ͬ�¶ȶ�CO2��ת���ʼ�������Ч��Ӱ����ͼ��ʾ�������й�˵������ȷ����_______������ţ���
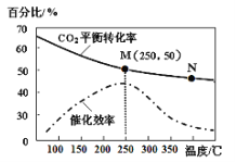
�ٲ�ͬ�����·�Ӧ��N����������
��M��ʱƽ�ⳣ����N��ʱƽ�ⳣ����
���¶ȵ���250��ʱ�����¶�������ϩ�IJ�������
��ʵ�ʷ�ӦӦ�������ڽϵ͵��¶��½��У������CO2��ת����
��4�����ܱ������г���5mol CO��4mol NO������������1����ij��Ӧ����ͼΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��
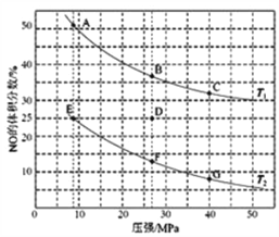
�ش��������⣺
���¶ȣ�T1______ T2������<������>������
��ij�¶��£�����Ӧ���е�10���Ӵﵽƽ��״̬D��ʱ�����������Ϊ2L�����ʱ��ƽ�ⳣ��K=______��������λ��Ч���֣�����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����V(CO)=________��
������D��Է�Ӧ�������µ�ͬʱ�����������ϵѹǿ��С�����´ﵽ��ƽ��״̬������ͼ��A��G���е�_______�㡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�صĻ�ѧ������Ҫ������
A.��Ҫ���ϼ�B.���������
C.ԭ�Ӱ뾶D.����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ 2Na+O2![]() Na2O2��2Na2O2+2H2O=4NaOH+O2����2Na2O2+2CO2=2NaCO3+O2����������������������������Ż���ǣ���
Na2O2��2Na2O2+2H2O=4NaOH+O2����2Na2O2+2CO2=2NaCO3+O2����������������������������Ż���ǣ���
A. �ɱ����� B. ˮ C. ��ɳ D. ��ĭ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com