
| A. | 化学变化一定伴随能量变化 | |
| B. | 化学变化一定有化学键的断裂和生成 | |
| C. | 化学变化一定伴随物质的状态变化 | |
| D. | 化学变化一定有新物质生成 |
分析 化学反应的实质为化学键的断裂与形成,则化学反应一定有新物质的生成,一定伴随着能量变化,但是不一定伴随物质的状态变化,据此进行解答.
解答 解:A.化学反应的实质为化学键的旧键断裂与新键形成,旧键断裂吸收能量、新键形成放出能量,则化学变化中一定伴随着能量变化,故A正确;
B.化学反应的实质为化学键的旧键断裂与新键形成,故B正确;
C.化学反应中一定有物质变化和能量变化,但是不一定存在物质状态的变化,如臭氧与氧气的转化中不存在物质状态的变化,故C错误;
D.任何化学变化中都一定存在新物质的生成,故D正确;
故选C.
点评 本题考查了化学反应的实质,题目难度不大,明确化学反应中一定伴随着物质变化和能量变化即可解答,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:
现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
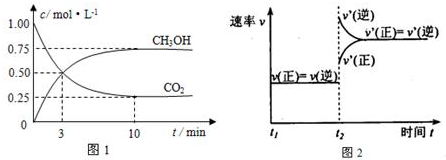
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量与6.02×1023个硫酸分子的质量在数值上相等 | |
| B. | 6.02×1023个N2和6.02×1023个H2的质量比等于14:1 | |
| C. | 1 mol臭氧和1.5 mol氧气含有相同数目的氧原子 | |
| D. | 常温、常压下,0.5×6.02×1023个一氧化碳分子质量是28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ②④⑤ | D. | ②⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持容器容积不变,向其中再加入1mol H2,反应速率加快,理由是增大反应物氢气的浓度,反应速率加快 | |
| B. | 保持容器内气体压强不变,向其中加入1mol N2(N2不参加反应),反应速率减慢,理由是保持压强不变,向其中充入N2,体积变大,反应物浓度减小,反应速率减慢 | |
| C. | 保持容器容积不变,向其中加入1mol N2(N2不参加反应),反应速率不变,理由是反应物的浓度不变,反应速率不变 | |
| D. | 保持容器内气体压强不变,向其中再加入1mol H2(g)和1mol I2(g),反应速率减小,理由是容器体积变大反应物浓度变小,反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 | |
| B. | 液氨中含有NH3、NH4+、NH2-等粒子 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com