
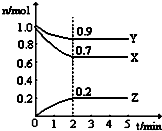
 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:| △c |
| △t |
 ?2NH3(g)可知,X线表示H2,Y线表示N2,Z线表示NH3,
?2NH3(g)可知,X线表示H2,Y线表示N2,Z线表示NH3,| △c |
| △t |
| ||
| 2min |
 ?2NH3(g)中,根据反应物键能减去生成物键能可得反应热为:△H=(946kJ+3×436kJ-6×391kJ)/mol=-92kJ/mol,故该反应为放热反应,放出热量为92KJ,故答案为:放热;92KJ.
?2NH3(g)中,根据反应物键能减去生成物键能可得反应热为:△H=(946kJ+3×436kJ-6×391kJ)/mol=-92kJ/mol,故该反应为放热反应,放出热量为92KJ,故答案为:放热;92KJ.


科目:高中化学 来源: 题型:
| A、在一定条件下,使用催化剂能加快反应速率 |
| B、当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变 |
| C、单位时间内生成CO和消耗Cl2的物质的量比为1:1时,反应达到平衡状态 |
| D、平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素X的原子最外层电子数是其内层的3倍.元素Y基态原子的3p轨道上有4个电子.元素Z位于第四周期,ⅡB族.
元素X的原子最外层电子数是其内层的3倍.元素Y基态原子的3p轨道上有4个电子.元素Z位于第四周期,ⅡB族.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 .请回答:
.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 起始温度t1/℃ | 终止温度 T2/℃ |
温度差 △t/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然气、石油、潮汐、风力为二次能源 |
| B、无限制的开采地下水,以满足社会对水的需求 |
| C、日常生活中无水乙醇常用于杀菌消毒 |
| D、水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com