
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)分析 (1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子;
(2)F的非金属性很强,HF分子之间能形成氢键;
(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)I3-离子的中心原子周围σ键电子对对数为2,孤电子对个数=$\frac{1}{2}$(7+1-2×1),根据价层电子对互斥理论确定空间构型;
离子晶体的晶格能与离子半径成反比,与离子所带电荷成正比;
(6)根据价层电子对互斥理论来确定其杂化方式,价层电子对个数=σ键个数+孤电子对个数;等电子体是具有相同的价电子数和相同原子数的微粒;
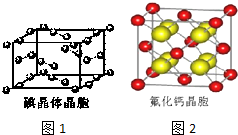
(7)碘为分子晶体,晶胞中占据顶点和面心,以此分析;
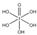
(8)利用均摊法确定该立方体中含有的离子数目,最近相邻的两个Ca2+的核间距为a cm,则晶胞棱长=$\frac{\sqrt{2}}{2}$×2a cm=$\sqrt{2}$a cm,根据ρV=nM计算相对分子质量.
解答 解:(1)卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区;
溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为:4s24p5,
故答案为:p;4s24p5;
(2)HF分子之间存在氢键,使氢氟酸分子缔合,故答案为:氢键;
(3)卤族元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,故答案为:I;
(4)H5IO6(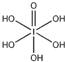 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO3,故答案为:<;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO3,故答案为:<;
(5)I3-离子的中心原子周围σ键电子对对数为2,孤电子对个数=$\frac{1}{2}$(7+1-2×1)=3,根据价层电子对互斥理论知,该微粒价层电子对个数是5且含有3个孤电子对,所以其空间构型为直线形;
离子晶体中离子电荷越多,半径越小离子键越强,离子晶体的晶格能越大,已知已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,所以发生的反应为CsICl2=CsCl+ICl,
故答案为:2;3;直线形;A;
(6)ClO2-中心氯原子的价层电子对数n=2+$\frac{7+1-2×2}{2}$=4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等,故答案为:sp3;Cl2O或OF2;
(7)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;
B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,故B错误
C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;
D.碘晶体中的碘原子间存在I-I非极性键,而晶体中分子之间存在范德华力,故D错误;
故答案为:A;
(8)该晶胞中含有钙离子个数=$\frac{1}{8}$×8+$\frac{1}{2}$×6=4,含有氟离子个数=8,近相邻的两个Ca2+的核间距为a cm,则晶胞棱长=$\frac{\sqrt{2}}{2}$×2a cm=$\sqrt{2}$a cm,故晶胞体积=($\sqrt{2}$acm)3=2$\sqrt{2}$a3 cm3,故ρ×2$\sqrt{2}$a3 =$\frac{4}{{N}_{A}}$×M,则M=$\frac{\sqrt{2}{a}^{3}ρ{N}_{A}}{2}$,故答案为:$\frac{\sqrt{2}{a}^{3}ρ{N}_{A}}{2}$.
点评 本题考查物质结构与性质,综合性强,涉及元素周期表、核外电子排布、分子结构与性质、电离能、晶体结构与性质、杂化轨道、等电子体、晶胞计算等,侧重对主干知识的考查,需要学生熟练掌握基础知识,难点是晶胞计算.


科目:高中化学 来源: 题型:选择题
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 石油分馏和裂化的目的都是为了将长链烃转化为短链烃 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,导致蛋白质变性,失去生理活性 | |
| D. | 高分子化合物(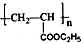 )的单体是CH2=CH2和C2H5COOH )的单体是CH2=CH2和C2H5COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的或结论 |
| A | 取一个小木条,放入饱和硅酸钠溶液中,充分吸湿、浸透,取出稍沥干后,置于酒精灯外焰处,木条未燃烧 | 证明硅酸钠可作木材防火剂 |
| B | 向取好未知浓度氢氧化钠溶液的锥形瓶中加入2mL酚酞,然后进行正确滴定,最后一滴盐酸滴入,溶液由红色变为无色且半分钟不恢复 | 准确判断已知浓度的盐酸滴定未知浓度的氢氧化钠溶液的滴定的终点 |
| C | 向装有石灰石的简易启普发生器中加入浓醋酸,将产生的气体先通入饱和碳酸氢钠溶液,再通入苯酚钠溶液中,苯酚钠溶液产生浑浊 | 酸性:醋酸>碳酸>苯酚 |
| D | 向盛有苯酚的浓溶液的试管里逐滴加入稀溴水,边滴边振荡 | 苯酚的定性检验 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA | |
| B. | 标准状况下,11.2 L 二氯甲烷中含有的分子数目为0.5NA | |
| C. | 常温常压下,28 g乙烯与丙烯的混合气体含有的碳原子数目无法计算 | |
| D. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g冰的晶体中含有氢键的数目为2 NA | |
| B. | 11.2 L丙烷(标准状况)中含有σ键的数目为5NA | |
| C. | 2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA | |
| D. | 1 mol C12与足量NaOH溶液反应,转移电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molNaN3所含阴离子总数为3NA | |
| B. | 常温常压下,28 g乙烯气体中σ键与π键数目之和为6NA | |
| C. | 标准状况下,22.4L C12通入到足量FeBr2溶液中,被氧化的Br-数目为2NA | |
| D. | 500 mL 18 mol/L的H2SO4溶液与足量Cu共热,电子转移数目为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的热稳定性:D>E | |
| B. | 原子半径:A<B<C<D<E | |
| C. | B与C形成的化合物中不可能含共价键 | |
| D. | 最高价氧化物对应的水化物酸性最强的是E |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com