
(1)铁在潮湿的空气中容易发生电化腐蚀最后生成铁锈(Fe2O3.xH2O),则发生腐蚀时正极上发生反应的电极反应式为__________________。
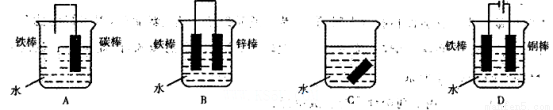
(2)下列哪些装置可防止铁棒被腐蚀__________________。
(3)在实际生产中,可在铁件的表面上镀铜防止铁被腐蚀。装置示意图如下左图:

①电镀时,镀件与电源的______________极连接,A电极对应的金属是______________(写元素名称),B电极的电极反应式是______________________。
②上右图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和
隔膜,该电池反应为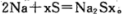 。该电池正极的电极反应式为___________________________。
。该电池正极的电极反应式为___________________________。
用该电池作电源进行上述铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为_________g。
(1)O2 + 2H2O + 4e- = 4OH-;
(2)BD
(3)①负极 铜 Cu2+ + 2e-=Cu ②xS+2e—=Sx2— 9.2
【解析】
试题分析:(1)铁在潮湿的空气中主要发生吸氧腐蚀,则发生腐蚀时正极上发生反应的电极反应式为O2 + 2H2O + 4e- = 4OH-;(2)A、该装置为原电池,铁棒作负极,发生氧化反应,加快铁棒的腐蚀,错误;B、该装置为原电池,铁棒作正极,被保护,为牺牲阳极保护法,正确;C、该装置不能防止铁棒被腐蚀,错误;D、该装置为电解池,铁棒作阴极,为阴极电保护法,正确;选BD;(3)①根据电镀池的构成:镀层金属作阳极,镀件作阴极,电解液为含有镀层金属阳离子的盐溶液知,在铁件的表面上镀铜,电镀时,镀件与电源的负极连接,A电极对应的金属是铜,B电极的电极反应式是Cu2+ + 2e-=Cu;②根据电池反应分析,硫元素的化合价降低,发生还原反应,作正极,电极反应式为xS+2e—=Sx2—;根据电镀时两极的电极反应式判断;阳极:Cu—2e- =Cu2+,阴极:Cu2+ + 2e-=Cu,及该原电池的负极反应式:Na—e-=Na+,利用电子守恒法计算;若电镀池中两电极的质量开始相同,电镀完成后二者质量差为25.6g,则转移的电子为0.4mol,则理论上该电池负极消耗的质量为9.2g。
考点:考查金属的腐蚀与防护、电解原理的应用、原电池原理及电化学计算。


科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
A.水可以电离出离子,所以是强电解质
B.水的离子积可表示KW=c(H+)·c(OH-)
C.常温下水中的c(H+)大于c(OH-)
D.升高温度,c(H+)增大,显弱酸性
查看答案和解析>>
科目:高中化学 来源:2015届天津市和平区高二上学期期末考试化学试卷(解析版) 题型:选择题
已知反应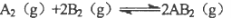 △H<O,下列说法正确的( )。
△H<O,下列说法正确的( )。
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:选择题
0.1 mol·L-1NaOH溶液和0.1 mol·L-1NH4C1溶液等体积混合,离子浓度大小正确的是
A.c(Na+)>c(C1-)>c(OH-)>c(H+)
B.c(Na+)=c(C1-)>c(OH-)>c(H+)
C.c(Na+)=c(C1-)>c(H+)>c(OH-)
D.c(C1-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:选择题
在pH=1的无色溶液中能大量共存的离子组是
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源:2015届天津市五区县高二上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.两种难溶物质比较,溶度积小的溶解度不一定小
B.水的离子积常数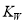 随着温度的升高而增大,说明水的电离是放热反应
随着温度的升高而增大,说明水的电离是放热反应
C.向0.1mol/L的氨水中加入少量硫硫酸固体,则溶液中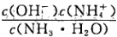 增大
增大
D:0.1mol/L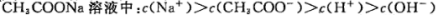
查看答案和解析>>
科目:高中化学 来源:2015届天津市五区县高二上学期期末考试化学试卷(解析版) 题型:选择题
工业制氢气的一个重要反应是:
已知在25℃时:
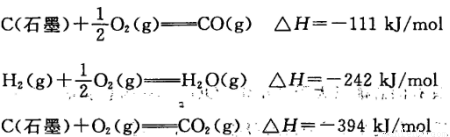
则2 5℃时1 mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为:

查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二教学评估(一)化学试卷(解析版) 题型:选择题
下列关于芳香烃的叙述中不正确的是
A.乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响。
B.苯和浓硝酸、浓硫酸混合物在100—1100C才能生成二硝基苯,而甲苯在1000 C时即可生成三硝基甲苯,说明甲基对苯环产生了影响。
C.甲苯、苯乙烯、萘、硝基苯均属于芳香烃,其工业上主要来源为石油和煤。
D.除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,充分反应后再加入足量的NaOH溶液,然后分液即可。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com