
| M(OH)n | KSP | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-52 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-38 | 5.9 | 8.9 |
分析 (1)电极材料由NiO2、Fe和碳粉涂在铝箔上制成,放电过程中产生Ni(OH)2和Fe(OH)2,铁做负极,NiO2做正极发生还原反应生成Ni(OH)2,结合电荷守恒和原子守恒配平书写电极反应;
(2)依据I=$\frac{P}{U}$,Q=tI,电池工作时铁失电子发生氧化反应生成+2价铁,结合电子守恒计算;
(3)废电池电极材料加入盐酸溶解,得到氯化镍、氯化亚铁、氯化铝,加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+,加入NiO的目的是调节溶液PH值,先后沉淀铁离子和铝离子,加入NiO固体,则开始析出沉淀时的离子方程式是:NiO+2H+=Ni2++H2O,Fe3++3H2O=Fe(OH)3↓+3H+,铝离子后沉淀,当铝离子浓度小于或等于1×10-5mol/L为完全沉淀,Al(OH)3的Ksp=2.0×10-32,则此时c3(OH-)=$\frac{{K}_{sp}}{c(A{l}^{3+})}$=$\frac{2.0×1{0}^{-32}}{1×1{0}^{-5}}$,c(OH-)=$\root{3}{2}$×10-9mol/L,c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{\root{3}{2}×1{0}^{-9}}$,PH=-lg(H+)=5.1,当PH=5.9时,镍离子开始沉淀,则PH控制在5.1~5.9时,铁离子和铝离子都沉淀析出,过滤得到Fe(OH)3,Al(OH)3,氢氧化铝是两性氢氧化物,把氢氧化铁和氢氧化铝溶于过量氢氧化钠溶液中过滤得到滤渣为氢氧化铁沉淀,滤液为偏铝酸钠溶液,再通入过量二氧化碳沉淀出氢氧化铝;
(4)滤液A为氯化钠溶液,电解时阴极得到氢气,阳极得到氯气;通入的气体为Cl2,氯气、氢氧化钠溶液和NiC2O4•H2O反应生成Ni(OH)3.
解答 解:(1)电极材料由NiO2、Fe和碳粉涂在铝箔上制成,放电过程中产生Ni(OH)2和Fe(OH)2,铁做负极,NiO2做正极发生还原反应生成Ni(OH)2,结合电荷守恒和原子守恒配平书写电极反应为:NiO2+2H2O+2e-=Ni(OH)2+2OH-,
故答案为:Fe;NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)电池输出电压为3V,给2W灯泡供电,电流I=$\frac{P}{U}$=$\frac{2}{3}$A,消耗0.02gFe,铁失电生成+2价铁,电子转移总物质的量=$\frac{0.02g}{56g/mol}$×2=0.000714mol,
理论电池工作时间t=$\frac{Q}{I}$=$\frac{0.000714mol×96500C/mol}{\frac{2}{3}A}$=103.3515s≈1.72min,
故答案为:1.72;
(3)方案中加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+,加入NiO的目的是调节溶液PH值,先后沉淀铁离子和铝离子,加入NiO固体,则开始析出沉淀时的离子方程式是:NiO+2H+=Ni2++H2O,Fe3++3H2O=Fe(OH)3↓+3H+,铝离子后沉淀,当铝离子浓度小于或等于1×10-5mol/L为完全沉淀,Al(OH)3的Ksp=2.0×10-32,则此时c(OH-)3=$\frac{{K}_{sp}}{c(A{l}^{3+})}$=$\frac{2.0×1{0}^{-32}}{1×1{0}^{-5}}$,c(OH-)=$\root{3}{2}$×10-9mol/L,c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{\root{3}{2}×1{0}^{-9}}$,PH=-lg(H+)=5.1,当PH=5.9时,镍离子开始沉淀,则PH控制在5.1~5.9时,铁离子和铝离子都沉淀析出,过滤得到Fe(OH)3,Al(OH)3,氢氧化铝是两性氢氧化物,把氢氧化铁和氢氧化铝溶于过量氢氧化钠溶液中过滤得到氢氧化铁沉淀,滤液为偏铝酸钠溶液,再通入过量二氧化碳沉淀出氢氧化铝,具体步骤为:将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3,
故答案为:将溶液中的Fe2+氧化为Fe3+;NiO+2H+=Ni2++H2O;Fe3++3H2O=Fe(OH)3↓+3H+;5.1~5.9之间;将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3;
(4)滤液A为氯化钠溶液,电解时阴极得到氢气,阳极得到氯气;要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的C即Cl2,故答案为:NaCl溶液;H2;Cl2;C;要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
点评 本题考查了物质分离提纯实验过程分析判断,涉及原电池原理的理解应用和电极反应书写、电子守恒的计算、难溶电解质的计算、电解综合运用,综合性强,计算量大,有一定难度.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E | N | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | 稳定性:HG>HN;熔沸点:HG>HN | |
| B. | 工业上常用电解熔融DN3的方法冶炼D单质 | |
| C. | B、C原子的价电子数相同 | |
| D. | 0.1mol/L的最高价氧化物的水化物溶液的pH:A≠N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 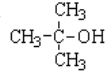 | B. | 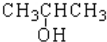 | C. | 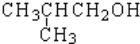 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是置换反应,HCl表现还原性 | |
| B. | 反应②是复分解反应,HCl表现氧化性 | |
| C. | 反应③中HCl既有氧化性也有还原性 | |
| D. | 反应①中氧化剂和氧化产物的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一纸多用,尽量提高纸张的使用效率 | |
| B. | 回收处理,不乱扔、乱丢废纸屑 | |
| C. | 在高浓度氧气中燃烧,不产生废弃物 | |
| D. | 积累、保存送造纸厂处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除⑤外 | B. | 仅④⑤ | C. | 仅①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高的温度都难以分解 | |
| B. | 乙醇能和水以任意比例互溶 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性以此减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com