
| A. | A | |
| B. | B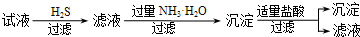 | |
| C. | C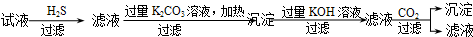 | |
| D. | D |
分析 通入H2S可的到CuS沉淀,加入过量KOH,生成AlO2-,通入过量二氧化碳气体生成Al(OH)3沉淀,加入过量氨水Cu(OH)2溶解,Mg2+、Al3+与碳酸根离子发生互促水解生成Mg(OH)2和Al(OH)3,以此解答该题.
解答 解:A.通入H2S可得到CuS沉淀,加入过量KOH得到Mg(OH)2沉淀,过滤后在溶液中通入过量二氧化碳气体生成Al(OH)3沉淀,K+存在与滤液中,故A正确;
B.通入H2S可得到CuS沉淀,加入过量氨水生成Mg(OH)2和Al(OH)3,加入盐酸沉淀溶解又生成Mg2+、Al3+,不能分离,故B错误;
C.通入H2S可得到CuS沉淀,滤液中加入过量碳酸钾溶液生成Mg(OH)2和Al(OH)3,加入过滤KOH溶解Al(OH)3,过滤后通入过量二氧化碳气体生成Al(OH)3沉淀,K+存在与滤液中,故C正确;
D.加入过量KOH得到Mg(OH)2和Cu(OH)2,加入过量氨水Cu(OH)2溶解,可分离Mg(OH)2和Cu(OH)2,过滤后在溶液中通入过量二氧化碳气体生成Al(OH)3沉淀,K+存在与滤液中,故D正确.
故选B.
点评 本题考查物质的分离、提出的实验方案的评价,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意把握相关物质的性质,为解答该题的关键、


科目:高中化学 来源: 题型:选择题
| A. | 体积相同、浓度均为0.1 mol•L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n | |
| B. | 有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1 | |
| C. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中c(H+)之比为2:1 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=$\frac{c{α}^{2}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,K变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
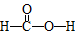 ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究: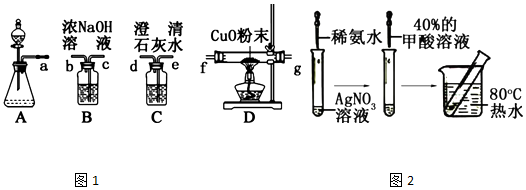
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 根据要求回答下列问题:
根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此沉淀是Mg(OH)2、Ca(OH)2的混合物 | |
| B. | 此沉淀只有Mg(OH)2 | |
| C. | 过滤后滤液中存在Ca2+、Mg2+ | |
| D. | 向原溶液中加入8.8 g NaOH固体,不可以使Ca2+部分转化为沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 | |
| D. | 锥形瓶内溶液颜色由黄色变橙色,立即记下滴定管内液面所在刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
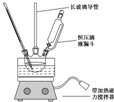 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: +HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+
+HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+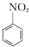 +H2O
+H2O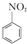 +HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$
+HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$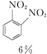 +
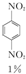
+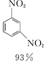 +
+
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
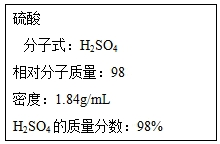
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
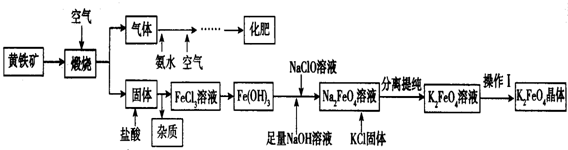
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com