
 H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1 O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
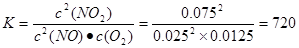 .由于化学平衡常数只与温度有关,而与浓度无关,温度没变,所以化学平衡常数就不变。(5)在反应开始时c(NO2)=0.1mol/L;假设在反应过程中c(O2)=xmol/L,则当反应得到平衡时各种物质的浓度分别是c(NO2)=(0.1-2x)mol/L; c(NO)=" 2xmol/L;" c(NO2)=xmol/L。根据化学平衡常数的含义可得
.由于化学平衡常数只与温度有关,而与浓度无关,温度没变,所以化学平衡常数就不变。(5)在反应开始时c(NO2)=0.1mol/L;假设在反应过程中c(O2)=xmol/L,则当反应得到平衡时各种物质的浓度分别是c(NO2)=(0.1-2x)mol/L; c(NO)=" 2xmol/L;" c(NO2)=xmol/L。根据化学平衡常数的含义可得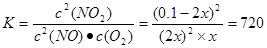 。解得x=0.0125mol/L,所以NO2的转化率为(2×0.0125mol/L)÷0.1mol/L×100%=25%.
。解得x=0.0125mol/L,所以NO2的转化率为(2×0.0125mol/L)÷0.1mol/L×100%=25%.

科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①③ | C.①② | D.① |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
| 离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
| c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
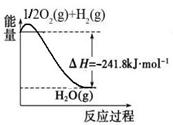
 CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。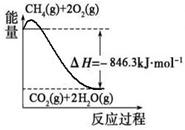
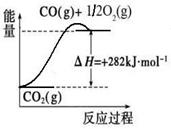
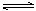 [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。 CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0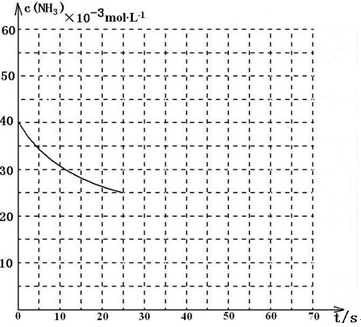
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
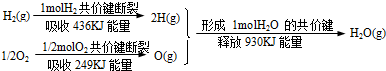
| A.1molH2和0.5molO2所具有的总能量低于1mol气态H2O所具有的总能量 |
| B.氢气跟氧气反应生成水的同时吸收能量 |
| C.1molH2跟1/2molO2反应生成1molH2O(l)释放能量一定是245kJ |
| D.2molH2(g)跟1molO2(g)反应生成2molH2O(g)释放能量490kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1 CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1| A.降低温度 | B.补充CO2 | C.加入催化剂 | D.移去甲醇 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) ΔH1<0①
CO2(g) ΔH1<0① CO(g)+H2(g) ΔH2>0②
CO(g)+H2(g) ΔH2>0② 2CO2(g) ΔH3<0③
2CO2(g) ΔH3<0③ 2H2O(g) ΔH4<0④
2H2O(g) ΔH4<0④ CO2(g) ΔH1="-393.5" kJ·mol-1
CO2(g) ΔH1="-393.5" kJ·mol-1 2CO2(g) ΔH2="-566" kJ·mol-1
2CO2(g) ΔH2="-566" kJ·mol-1 TiCl4(s)+O2(g) ΔH3="+141" kJ·mol-1
TiCl4(s)+O2(g) ΔH3="+141" kJ·mol-1 TiCl4(s)+2CO(g)的ΔH= 。
TiCl4(s)+2CO(g)的ΔH= 。  2Fe(s)+3CO2(g) ΔH1="-25" kJ·mol-1
2Fe(s)+3CO2(g) ΔH1="-25" kJ·mol-1 2Fe3O4(s)+CO2(g) ΔH2="-47" kJ·mol-1
2Fe3O4(s)+CO2(g) ΔH2="-47" kJ·mol-1 3FeO(s)+CO2(g) ΔH3="+640" kJ·mol-1
3FeO(s)+CO2(g) ΔH3="+640" kJ·mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com