
ĻņĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2 mol SO2ŗĶ1 mol O2£¬²āµĆĘšŹ¼ČŻĘ÷Ń¹ĒæĪŖp£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗ2SO2(g)£«O2(g) 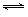 2SO3(g) ”÷H£½-196 kJ”¤mol£1£¬Ī¬³ÖČŻĘ÷ĪĀ¶Č²»±ä£¬²āµĆĘ½ŗāŹ±ČŻĘ÷ÄŚŃ¹ĒæĪŖ0.7p£¬Čō“ĖŹ±ŌŁĻņČŻĘ÷ÖŠ³äČė2 mol SO3£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
2SO3(g) ”÷H£½-196 kJ”¤mol£1£¬Ī¬³ÖČŻĘ÷ĪĀ¶Č²»±ä£¬²āµĆĘ½ŗāŹ±ČŻĘ÷ÄŚŃ¹ĒæĪŖ0.7p£¬Čō“ĖŹ±ŌŁĻņČŻĘ÷ÖŠ³äČė2 mol SO3£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®³äČė2 mol SO3ŗó£¬SO2µÄĪļÖŹµÄĮæŌö“ó
B£®µŚŅ»“Ī·“Ó¦“ļµ½Ę½ŗāŹ±¹²·Å³öČČĮæ176.4 kJ
C£®³äČė2 mol SO3“ļµ½ŠĀĘ½ŗāŹ±£¬ČŻĘ÷ÄŚµÄŃ¹ĒæĪŖ1.4p
D£®½µµĶČŻĘ÷µÄĪĀ¶ČæÉŹ¹ŠĀĘ½ŗāŹ±ø÷ĪļÖŹµÄĢå»ż·ÖŹżÓėµŚŅ»“ĪĘ½ŗāŹ±ĻąĶ¬
 Õć½Ö®ŠĒæĪŹ±ÓÅ»Æ×÷ŅµĻµĮŠ“š°ø
Õć½Ö®ŠĒæĪŹ±ÓÅ»Æ×÷ŅµĻµĮŠ“š°ø ¼¤»īĖ¼Ī¬ÓżÓæĪĢĆĻµĮŠ“š°ø
¼¤»īĖ¼Ī¬ÓżÓæĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÄÜŌ“¶ĢȱŹĒČĖĄąÉē»įĆęĮŁµÄÖŲ“óĪŹĢā”£¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠ¹ć·ŗµÄæŖ·¢ŗĶÓ¦ÓĆĒ°¾°”£
£Ø1£©¹¤ŅµÉĻŅ»°ć²ÉÓĆĻĀĮŠĮ½ÖÖ·“Ó¦ŗĻ³É¼×“¼£ŗ
·“Ó¦I£ŗCO(g) £« 2H2(g) ![]() CH3OH(g) ¦¤H1
CH3OH(g) ¦¤H1
·“Ó¦II£ŗ CO2(g) £« 3H2(g) ![]() CH3OH(g) + H2O(g) ¦¤H2
CH3OH(g) + H2O(g) ¦¤H2
ÓŅĶ¼ŹĒ·“Ó¦I·“Ó¦¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆĒśĻß”£
£Ø1£©ÓÉÓŅĶ¼æÉÖŖ·“Ó¦IĪŖ ·“Ó¦£ØŃ”Ģī”±ĪüČČ”¢·ÅČČ”±£©£¬·“Ó¦ČČ”÷H1£½
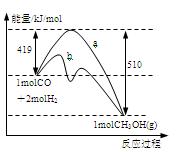
£Ø2£©·“Ó¦IŌŚŅ»¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ÄÜÅŠ¶ĻĘäŹĒ·ń“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ ”£
A£®ČŻĘ÷ÖŠŃ¹Ēæ²»±ä B£®»ģŗĻĘųĢåÖŠc£ØCO£©²»±ä
C£®vÕż£ØH2£©£½vÄę£ØCH3OH£© D£®c£ØCO£©£½c£ØCH3OH£©
£Ø3£©Ķ¼ÖŠĒśĻß ±ķŹ¾Ź¹ÓĆ“ß»Æ¼ĮŹ±·“Ó¦µÄÄÜĮæ±ä»Æ”£
£Ø4£©Ņ»¶ØĢõ¼žĻĀ£¬ĻņĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2 mol CO2ŗĶ6 mol H2£¬Ņ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗāדĢ¬£¬²āµĆCH3OH(g)µÄĪļÖŹµÄĮæĪŖ1mol£¬Ōņ“ĖĢõ¼žĻĀøĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżŹż
KÖµ= £ØÓĆ·ÖŹż±ķŹ¾£©£¬ČōæŖŹ¼Ź±³äČė2 mol CH3OH(g) ŗĶ2 mol H2O(g)“ļµ½ĻąĶ¬Ę½ŗāŹ±CH3OHµÄ×Ŗ»ÆĀŹĪŖ £¬ČōĘ½ŗāŗóŌŚ³äČė4 molµÄN2£¬ŌņC(CO2)ŹĒ ”£
£Ø5£©“ÓĀĢÉ«»ÆѧµÄ½Ē¶Č±Č½ĻÉĻŹöĮ½ÖÖ·½·Ø£¬·ūŗĻŌ×Ó¾¼ĆµÄŹĒ ”££ØĢī”°I”± »ņ”°II”±£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012½ģ½ĖÕŹ”ø·ÄžøßÖŠ”¢“ó·įøßÖŠ”¢Ž²čøßÖŠøßČżµŚ¶ž“Īµ÷ŃŠĮŖæ¼»ÆѧŹŌ¾ķ ĢāŠĶ£ŗµ„Ń”Ģā
ĻņĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2 mol SO2ŗĶ1 mol O2£¬²āµĆĘšŹ¼ČŻĘ÷Ń¹ĒæĪŖp£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗ2SO2(g)£«O2(g)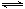 2SO3(g) ”÷H£½-196 kJ”¤mol£1£¬Ī¬³ÖČŻĘ÷ĪĀ¶Č²»±ä£¬²āµĆĘ½ŗāŹ±ČŻĘ÷ÄŚŃ¹ĒæĪŖ0.7p£¬Čō“ĖŹ±ŌŁĻņČŻĘ÷ÖŠ³äČė2 mol SO3£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
2SO3(g) ”÷H£½-196 kJ”¤mol£1£¬Ī¬³ÖČŻĘ÷ĪĀ¶Č²»±ä£¬²āµĆĘ½ŗāŹ±ČŻĘ÷ÄŚŃ¹ĒæĪŖ0.7p£¬Čō“ĖŹ±ŌŁĻņČŻĘ÷ÖŠ³äČė2 mol SO3£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
| A£®³äČė2 mol SO3ŗó£¬SO2µÄĪļÖŹµÄĮæŌö“ó |
| B£®µŚŅ»“Ī·“Ó¦“ļµ½Ę½ŗāŹ±¹²·Å³öČČĮæ176.4 kJ |
| C£®³äČė2 mol SO3“ļµ½ŠĀĘ½ŗāŹ±£¬ČŻĘ÷ÄŚµÄŃ¹ĒæĪŖ1.4p |
| D£®½µµĶČŻĘ÷µÄĪĀ¶ČæÉŹ¹ŠĀĘ½ŗāŹ±ø÷ĪļÖŹµÄĢå»ż·ÖŹżÓėµŚŅ»“ĪĘ½ŗāŹ±ĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğøŹĖąŹ”ĪäĶžŹŠøßČżÉĻѧʌµŚĪå“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖ£ŗCO2(g) + 3H2(g)  CH3OH(g)
+ H2O(g) ¦¤H£½£49.0 kJ•mol£1”£Ņ»¶ØĢõ¼žĻĀ£¬ĻņĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2 mol
CO2ŗĶ6 mol H2£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÖŠ£¬ÕżČ·µÄŹĒ
CH3OH(g)
+ H2O(g) ¦¤H£½£49.0 kJ•mol£1”£Ņ»¶ØĢõ¼žĻĀ£¬ĻņĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2 mol
CO2ŗĶ6 mol H2£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÖŠ£¬ÕżČ·µÄŹĒ

A£®10minŗó£¬ÉżøßĪĀ¶ČÄÜŹ¹ Ōö“ó
Ōö“ó
B£®·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬CO2µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ75%
C£®3 minŹ±£¬ÓĆCO2µÄÅØ¶Č±ķŹ¾µÄÕż·“Ó¦ĖŁĀŹµČÓŚÓĆCH3OHµÄÅØ¶Č±ķŹ¾µÄÄę·“Ó¦ĖŁĀŹ
D£®“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬H2µÄĘ½¾ł·“Ó¦ĖŁĀŹ¦Ō(H2)£½0.075 mol”¤L£1•min£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğ½ĖÕŹ””¢“ó·įøßÖŠ”¢Ž²čøßÖŠøßČżµŚ¶ž“Īµ÷ŃŠĮŖæ¼»ÆѧŹŌ¾ķ ĢāŠĶ£ŗŃ”ŌńĢā
ĻņĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2 mol
SO2ŗĶ1 mol O2£¬²āµĆĘšŹ¼ČŻĘ÷Ń¹ĒæĪŖp£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗ2SO2(g)£«O2(g)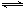 2SO3(g)
”÷H£½-196 kJ”¤mol£1£¬Ī¬³ÖČŻĘ÷ĪĀ¶Č²»±ä£¬²āµĆĘ½ŗāŹ±ČŻĘ÷ÄŚŃ¹ĒæĪŖ0.7p£¬Čō“ĖŹ±ŌŁĻņČŻĘ÷ÖŠ³äČė2 mol SO3£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
2SO3(g)
”÷H£½-196 kJ”¤mol£1£¬Ī¬³ÖČŻĘ÷ĪĀ¶Č²»±ä£¬²āµĆĘ½ŗāŹ±ČŻĘ÷ÄŚŃ¹ĒæĪŖ0.7p£¬Čō“ĖŹ±ŌŁĻņČŻĘ÷ÖŠ³äČė2 mol SO3£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®³äČė2 mol SO3ŗó£¬SO2µÄĪļÖŹµÄĮæŌö“ó
B£®µŚŅ»“Ī·“Ó¦“ļµ½Ę½ŗāŹ±¹²·Å³öČČĮæ176.4 kJ
C£®³äČė2 mol SO3“ļµ½ŠĀĘ½ŗāŹ±£¬ČŻĘ÷ÄŚµÄŃ¹ĒæĪŖ1.4p
D£®½µµĶČŻĘ÷µÄĪĀ¶ČæÉŹ¹ŠĀĘ½ŗāŹ±ø÷ĪļÖŹµÄĢå»ż·ÖŹżÓėµŚŅ»“ĪĘ½ŗāŹ±ĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com