
今有室温下四种溶液,有关叙述不正确的是
| ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.已知醋酸铵溶液呈中性,在①、②两中分别加入适量的氯化铵晶体或醋酸铵晶体后,两溶液的pH均减小
B.四种溶液分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4, 则Va ∶Vb=11∶9
C
【解析】
试题分析:A、已知醋酸铵溶液呈中性,这说明醋酸和氨水的电离程度是相同的。在①、②两中分别加入适量的氯化铵晶体或醋酸铵晶体后,NH4+结合OH-生成难电离的一水合氨,OH-浓度降低,两溶液的pH均减小,A正确;B、氢氧化钠和氯化氢是强电解质,完全电离。醋酸和氨水是弱酸与弱碱,存在电离平衡,稀释促进电离,则四种溶液分别加水稀释10倍,四种溶液的pH ①>②>④>③,B正确;C、氨水是弱碱,pH=11的氨水溶液浓度大于0.001mol/L,则①、④两溶液等体积混合,氨水过量,溶液显碱性,则所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),C不正确;D、VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4,这说明盐酸过量,则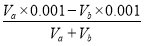 =0.0001,解得Va ∶Vb=11∶9,D正确,答案选C。
=0.0001,解得Va ∶Vb=11∶9,D正确,答案选C。
考点:考查弱电解质的电离、盐类水解、溶液稀释以及pH的计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:填空题
Ⅰ 在①CH2=CH2 ②C6H6 ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)能使Br2的CCl4溶液褪色的是________;
(2)属于高分子化合物的是________;
(3)能与Na2CO3溶液反应的是________;
(4)能发生酯化反应的是________;
(5)既能发生取代反应又能发生加成反应的是________。
Ⅱ A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量一定,完全燃烧后所产生的CO2的质量就不变,试写出两组符合上述情况的烃的结构简式:
(1)第一组 和 。
(2)第一组 和 。
(3)A、B应满足的条件是_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:实验题
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
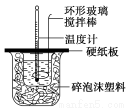
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热 (填“偏大”、“偏小”或“不变”)。
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会 (填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会 (填“偏大”、“偏小”或“不变”),其原因是 。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH= 。根据计算结果,写出该中和反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列能正确表示水解的离子方程式是
A.CH3COOH + H2O  CH3COO- + H3O+
CH3COO- + H3O+
B.NH4+ + H2O  NH3·H2O + H+
NH3·H2O + H+
C.CO32- + 2H2O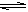 H2CO3 + 2OH-
H2CO3 + 2OH-
D.Br- + H2O  HBr + OH-
HBr + OH-
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:填空题
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g) (I)
(1)反应(I)中氧化剂是_______。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
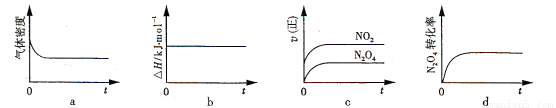
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____
_______________________________________________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1,假设溶液的体积是bL)
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.用坩埚钳夹住一小块铝箔在酒精灯上加热到熔化,但熔化的铝并不滴落,是因为铝表面生成了熔点更高的氧化铝。
B.铜属于重金属,它的化学性质不活泼,铜盐有毒,能使蛋白质失去活性,故误食铜盐后,应立即服用牛奶或蛋清急救再送医院治疗。
C.盐桥中通常装有琼脂的KCl溶液,形成如图所示原电池的闭合回路时,氯离子向正极移动,钾离子向负极移动。
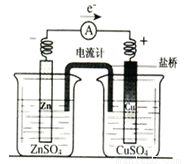
D.水的电离是吸热反应,升高温度,促进水的电离,水的离子积常数Kw变大。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列事实解释准确的是
A.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。脱氧过程中铁作原电池正极,电极反应为:Fe-2 e-=Fe2+
B.酸性氢氧燃料电池的正极电极反应为:2H2O+O2+4e-=4OH-
C.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,该反应的△S>0,说明反应△H>0
D.铅蓄电池的正极反应为:PbO2+4H++2 e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
建筑用的钢材在出厂前都要经过烤蓝处理,使其表面生成一层四氧化三铁,其目的是
A.增加钢材的硬度 B.增强钢材的抗腐蚀能力
C.使钢材美观 D.增加钢材的韧性
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
烃A最多可以与两倍于其物质的量的H2加成,当烃A与足量HCl加成后产物为B,B与四倍于其物质的量的Cl2反应才能得到完全卤代的产物,A是
A.1,3-丁二烯 B.乙炔 C.丁炔 D.乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com