
| A.消耗硫酸亚铁铵的物质量为n(3x+1)mol | B.处理废水中Cr2O72-的物质量为 mol mol |
| C.反应中发生转移的电子数为1.5nxmol | D.在FeO·FeyCrxO3中3x=y |
 mol,B正确;C.得到nmolFeO·FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,C错误;D、FeO·FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,D正确.
mol,B正确;C.得到nmolFeO·FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,C错误;D、FeO·FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,D正确.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题

| A.原混合酸中NO3-的物质的量为0.2 mol |
| B.原混合酸中H2SO4物质的量浓度为2mol/L |
| C.OA段与BC段反应中电子转移的物质的量之比为2:1 |
| D.取20mL原混合酸加水稀释至1L后溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 。则下列判断错误的是.
。则下列判断错误的是.| A.该反应能在瞬间完成,并产生大量气体 |
| B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol |
| C.该反应中的氧化剂为KNO3 |
| D.被氧化和被还原的N原子的物质的量之比为15:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3:2 | B.2:1 | C.1:1 | D.2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
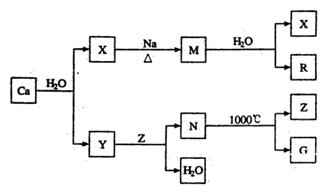
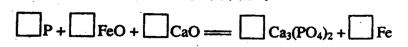
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 MnCl2 + C12↑ + 2H2O。下列说法不正确的是( )
MnCl2 + C12↑ + 2H2O。下列说法不正确的是( ) | A.还原剂是HCl,氧化剂是MnO2 |
| B.每生成1 mol Cl2,转移电子的物质的量为2 mol |
| C.每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol |
| D.转移电子的物质的量为1mol时,生成标准状况下Cl2的体积为11.2L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com