
| A. | NH3 | B. | CO2 | C. | H2 | D. | C2H4 |
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
下面一些报道中,你认为科学的是( )
A.疏通煤气管道时,充入氩气引起爆炸
B.新粉刷过石灰浆的墙壁释放出CO2使一老汉窒息而死
C.有易燃易爆物的工作场所,严禁穿化纤衣服
D.本饮料纯天然,绝对不含化学物质
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;氯离子的电子式
;氯离子的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液和胶体的本质区别为是否能产生丁达尔效应 | |
| B. | K2Cr2O7溶液和氢溴酸能存放于同一药品橱内 | |
| C. | 用带玻璃塞的细口试剂瓶保存氢氟酸 | |
| D. | CH4和C2H4均属于常用危险品中的易燃气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
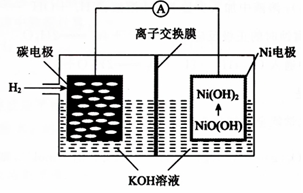
| A. | 离子交换膜选用阳离子交换膜(只允许阳离子通过) | |
| B. | 正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| C. | 导线中通过1mol电子时,理论上负极区溶液质量增加1g | |
| D. | 充电时,碳电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
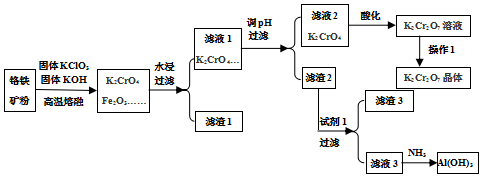
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘单质升华,克服的是其分子间作用力 | |
| B. | 金刚石、石墨、纳米碳管是碳元素的同素异形体 | |
| C. | 目前科学家还无法实现对原子或分子的操纵 | |
| D. | HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com