
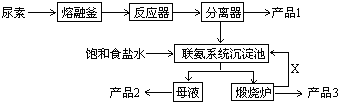
分析 (1)根据尿素的分子式CO(NH2)2计算出氮元素的质量分数;实验室熔化尿素需要在坩埚中进行;
(2)根据生产流程分析;
(3)联氨系统沉淀池中,加入饱和食盐水和二氧化碳,大大降低了碳酸氢钠的溶解度,析出碳酸氢钠晶体;
(4)工业上用二氧化碳和氨气反应来制取尿素;
(5)根据方程式判断;
(6)设出三聚氰胺的质量,然后根据反应原理计算出三聚氰胺的质量.
解答 解:(1)尿素的分子式CO(NH2)2,氮元素的质量分数为:$\frac{14×2}{60}$×100%=46.67%;在实验室熔化尿素需要在坩埚中进行;
故答案为:46.67%;坩埚;
(2)根据生产流程,分离器中分离出产品1三聚氰胺;联氨系统沉淀池中加入饱和食盐水和二氧化碳,析出碳酸氢钠晶体,母液主要是氯化铵溶液,利用母液得到产品2氯化铵;X是能够循环利用的二氧化碳;
故答案为:NH4Cl;CO2;
(3)由于联氨系统沉淀池中,加入饱和食盐水和二氧化碳,大大降低了碳酸氢钠的溶度积,析出碳酸氢钠晶体,所以联氨系统沉淀池中发生的化学反应方程式为:CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3;
故答案为:CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3;
(4)工业上合成尿素的化学反应方程式为:CO2+2NH3→CO(NH2)2+H2O,
故答案为:CO2+2NH3→CO(NH2)2+H2O;
(5)根据反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3,要从母液中析出更多的碳酸氢钠,可以向溶液中加入氯化钠或者通入二氧化碳气体;
故选A、D;
(6)设生成x吨三聚氰胺,根据方程:
6CO(NH2)2$\stackrel{一定条件下}{→}$C3N6H6+6NH3+3CO2
6×60 126
1t(1-4%) x
则有:360x=(1-4%)×126t,解得x=0.336t;
故答案为:0.336
点评 本题考查了工业流程,涉及的知识点较多、综合性较强,考查同学们灵活运用所学知识进行分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 电解AlCl3饱和溶液,可制得金属铝 | |
| B. | 铝热反应不仅被用于焊接钢轨,而且还常被用于冶炼熔点较高的金属 | |
| C. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 | |
| D. | Al2O3、MgO的熔点很高,可用于制作耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度时,两种饱和溶液中:c(Cl-)≈1.9c(Br-) | |
| B. | AgCl、AgBr组成的混合溶液中:c(Cl-)>c(Br-) | |
| C. | 向饱和AgCl溶液中通入HCl后有沉淀生成,但溶液中c(Cl-)增大 | |
| D. | AgBr在水中溶解度及Ksp均比在NaBr溶液中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Cr3+ | C. | Zn2+ | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
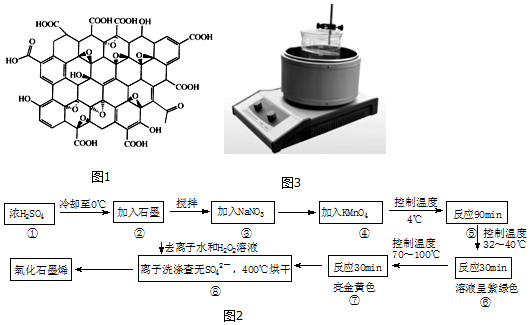
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com