
| A. | ①②⑤ | B. | ①③⑤ | C. | ①③④ | D. | ③④⑤ |
分析 ①煤炭中含有一定量的硫,用煤炭作民用燃料会向大气中排放出较多的SO2,改用天然气作民用燃料可减少SO2的排放量;
②提高热能利用率,这样可以降低煤的使用量,从而降低SO2的排放;
③使用催化剂无法提高二氧化硫的转化率;
④煤中的硫不一定都是硫单质,且现实操作复杂,二硫化碳造价高,增加了成本;
⑤燃煤中加石灰脱硫是工业上常用的比较有效的方法,氧化钙、硫、氧气等物质反应能生成硫酸钙,可以减少燃煤的过程中的SO2排放量.
解答 解:①民用煤是含有S元素的,天然气不含S,所以能减少SO2排放,故①正确;
②提高热能利用率,这样可以降低煤的使用量,从而降低SO2的排放,但此方法本身并不能降低SO2,而是通过降低煤的使用量减少SO2排放量,故②正确;
③催化剂只能提高反应速率,无法提高二氧化硫的转化率,故③错误;
④由于生产CS2的成本高,操作复杂,现实中无法实现使用CS2萃取大量煤炭中的硫,该操作方法不可行,故④错误;
⑤燃煤中加石灰脱硫,氧化钙、硫、氧气等物质进行反应,化学方程式为:2CaO+2S+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4,用这种方法可以减少燃煤的过程中的SO2排放量,故⑤正确;
故选A.
点评 本题考查了二氧化硫的污染及治理措施,题目难度不大,注意掌握二氧化硫的化学性质及对大气的污染,明确能够减少SO2排放量的措施.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:Na+、Fe2+、SO42-、NO3- | |
| B. | 某无色溶液中:Mg2+、ClO-、SO42-、Fe2+ | |
| C. | 能使KSCN变红的溶液中:NH4+、Na+、SiO32-、HCO3- | |
| D. | 水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| B. | 生铁比纯铁容易腐蚀 | |
| C. | 铁质器件附有的铜质配件,在接触处容易生铁锈 | |
| D. | 银质物品久置表面变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
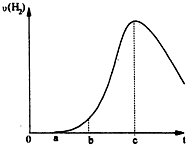 按要求完成下列问题:
按要求完成下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
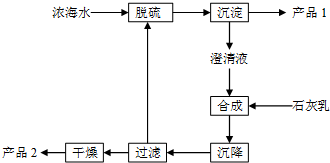 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品. _.
_.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子的能量越低,运动区域离原子核越远 | |
| B. | 核外电子的分层排布即是核外电子的分层运动 | |
| C. | 稀有气体元素原子的最外层都排有8个电子 | |
| D. | 当M层是最外层时,最多可排18个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com