
【题目】常温下,体积均为1L的HA、HB的两种一元酸溶液,分别向其中加水稀释至体积V,pH随lgV的变化关系如图所示。下列说法正确的是
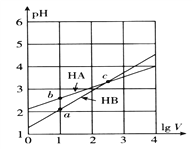
A. HA是弱酸,HB是强酸
B. 相同温度、相同浓度的NaA、NaB溶液的pH,后者大
C. c点处,分别加入足量的锌粒,HA中产生氢气多
D. a、b、c三点,由水电离出来的c(H+)·c(OH-)相等
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离NaCl和BaCl2两种固体混合物,回答下列问题:

供选试剂:Na 2CO3溶液、Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是______________。
(2)试剂a是________(填化学式,下同),试剂b是____________,固体B是________。
(3)加入试剂a所发生的化学反应方程式为_______________________________________。
(4)简述洗涤的操作步骤____________________________________________________________。
(5)该方案能否达到实验目的?___________。若不能,应如何改进(若能,此问不用回答)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的![]() 气体和
气体和![]() 气体,其分子数之比为 ______ ,氧原子数之比为 ______ ,相同条件下
气体,其分子数之比为 ______ ,氧原子数之比为 ______ ,相同条件下![]() 同温同压
同温同压![]() 的体积之比为 ______ ,密度之比为 ______ .
的体积之比为 ______ ,密度之比为 ______ .
(2)![]() 与
与![]() 的混合气体中,氧元素的质量分数为
的混合气体中,氧元素的质量分数为![]() ,则
,则![]() 与
与![]() 的物质的量之比是 ______ ,这种混合气体的密度是同温同压下氧气密度的 ______ 倍
的物质的量之比是 ______ ,这种混合气体的密度是同温同压下氧气密度的 ______ 倍![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物实际存在且命名正确的是 ( )
A. 3-甲基-2-丁烯 B. 2-甲基-5-乙基-1-已烷
C. 2,2-二甲基丁烷 D. 3,3-二甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“五室电渗析法”处理含硫酸钠废水的原理如图所示,以石墨为电极材料,室与室之间用离子交换膜分开(阳膜和阴膜分别只允许阳离子、阴离子通过),下列说法不正确的是 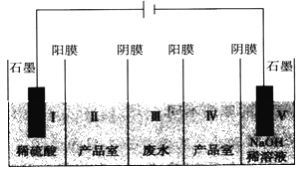
A. 阳极反应式为2H2O-4e-==O2↑+4H+,发生氧化反应
B. 通电片刻后,I、III、V室的pH依次减小、不变、增大
C. 当电路中通过1mol电子时,有1molSO42-从III室进入Ⅱ室
D. 总反应式为Na2SO4+4H2O![]() 2NaOH+H2SO4+O2↑+2H2↑
2NaOH+H2SO4+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体NaOH配制0.5 mol· L-1的NaOH溶液500 mL,有以下仪器和用品:①烧杯 ②100 mL量筒 ③500 mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,没有使用的仪器和用品有___(填序号),还缺少的仪器是______。
(2)在配制的转移过程中某学生进行如图操作,请指出其中的错误:______________。

(3)在容量瓶使用方法中,下列操作不正确的是____(填序号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用碱液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应FeO(s)+C(s)=CO(g)+ Fe(s) 的△H>0,△S >0(假定△H、△S不随温度而变化),下列叙述中正确的是( )
A. 低温下为自发过程,高温下为非自发过程 B. 高温下为自发过程,低温下为非自发过程
C. 任何温度下均为非自发过程 D. 任何温度下均为自发过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及硫化物广泛存在于自然界中,回答下列问题:
(1)基态S原子中,核外电子占据的最高能层的符号是___________,有__________种不同形状的电子云。
(2)(NH4)2SO4中O、N、S三种元素的第一电离能的大小关系为_______________________。
(3)中学化学常用KSCN检验Fe3+,列举一种与SCN-互为等电子体的分子:___________,SCN-中C原子的杂化方式为_________________。
(4)乙硫醇(CH3CH2SH)的相对分子质量比CH3CH2OH大,但乙醇的沸点高于乙硫醇的原因是_________________________________________________。
(5)PbS是一种重要的半导体材料,具有NaC1型结构(如图),其中阴离子采用面心立方最密堆积方式,X-射线衍射实验测得PbS的晶胞参数为a=0.594 n m。
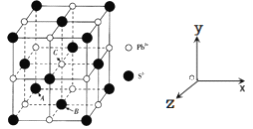
①已知坐标参数:A(0,0,0),B![]() ,则C的坐标参数为__________________。
,则C的坐标参数为__________________。
②PbS晶体中Pb2+的配位数为_________,r(S2-)为______nm。(已知![]() )
)
③PbS晶体的密度为_________g·cm-3。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下发生反应:m A(g)+n B(g) ![]() p C(g)+q D(g) ΔH,反应物起始浓度相同,现在不同的温度T1和T2下反应分别达到平衡状态,B转化率与温度的关系如图所示,则下列叙述正确的是
p C(g)+q D(g) ΔH,反应物起始浓度相同,现在不同的温度T1和T2下反应分别达到平衡状态,B转化率与温度的关系如图所示,则下列叙述正确的是

A. 平衡时D的体积分数:状态Ⅱ大于状态Ⅰ B. T1>T2
C. 平衡时正反应速率:状态Ⅱ比状态Ⅰ大 D. ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com