
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
(1) 写出甲醚燃烧的热化学方程式___________________ ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应:4C(s)+ 6H2(g)+ O2(g) = 2CH3OCH3(g)的反应热为___________
(2) 工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是___________(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”)
(3) 以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式___ _ ;
【答案】(1)CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455kJ/mol(3分) ;
△H=-378.8kJ/mol(2分)(2)①a d(2分);② 变小(2分)
(3)CH3OCH3+16OH――12e-=2CO32-+11H2O (3分)
【解析】
试题分析:(1)甲醚的燃烧热为1455kJ/mol,则燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;H2(g)和C(s)的燃烧热分别是285.8kJmol-1、393.5kJmol-1;热化学方程式①H2(g) +1/2O2(g) = H2O(l)△H = -285.8KJ/mol;②C(s) + O2(g) = CO2(g)△H = -393.5KJ/mol;③CH3OCH3(g) + 3O2(g) = 2CO2(g) + 3H2O(l)△H1 = -1455kJ/mol;依据盖斯定律计算①×3 + ②×2-③得到反应热化学方程式为:2C(s)+3H2(g)+1/2O2(g)=CH2OCH3(g) △H=-169.4kJ/mol;4C(s)+6H2(g)+O2(g)=2CH2OCH3(g)△H=-378.8kJ/mol;
(2)①a、在反应达平衡前,c(H2)与c(H2O)的比值在变小,故当c(H2)与c(H2O)的比值保持不变时,反应达平衡,a正确;b、单位时间内有2mol H2消耗时一定会有1mol H2O生成,故不能作为平衡的标志,b错误;c、本反应的反应物和生成物全是气体,根据质量守恒可知,在反应过程中气体的质量一直不变,而又是恒容的容器,即气体体积不变,故气体密度ρ=![]() 一直不变,故密度不变不能作为平衡的标志,c错误;d、此反应是个气体的物质的量有改变的反应,即在平衡之前,容器中气体的物质的量和压强在变化,故当压强不变时,说明反应达平衡,d正确;答案选ad;
一直不变,故密度不变不能作为平衡的标志,c错误;d、此反应是个气体的物质的量有改变的反应,即在平衡之前,容器中气体的物质的量和压强在变化,故当压强不变时,说明反应达平衡,d正确;答案选ad;
②反应放热,故升高温度,平衡左移,故CH3OCH3的产率将变小;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O。


科目:高中化学 来源: 题型:
【题目】根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各离子浓度的关系正确的是:
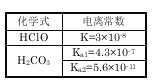
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3-)>c(H+)
C.c(ClO-)+c(HClO)=c(HCO3-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2+B2 ![]() 2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
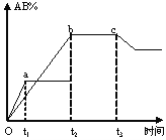
A.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
B.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
C.AB为气体,A2、B2中最少有一种为非气体,正反应放热
D.A2、B2、AB均为气体,正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:
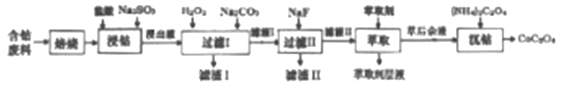
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等。
②部分阳离子一氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③Kap(MgF2)=7.35×10-11,Kap(CaF2)=1.05×10-10
回答下列问题:
(1)焙烧的目的是_________;浸钴过程中Co3+转化为Co2+,反应的离子方程式为_____________。
(2)加入H2O2的目的是__________,加入Na2CO3溶液,调pH至5.2,滤渣Ⅰ主要成分为__________。
(3)加入过量NaF溶液,可将Ca2+、Mg2+除去,若所得滤液中c(Ca2+)=1.0×10-5mol·L-1,则滤液中c(Mg2+)为_______________。
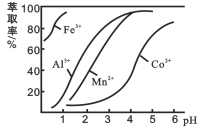
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示。滤液Ⅱ中加入萃取剂的作用是_________;萃取时,溶液的pH需要控制在一定范围内才比较适宜,其pH范围约为__________。
(5)已知含钴废料中含Co2O3质量分数为a%,若取mg该含钴废料按照上述流程,理论上最多能制得CoC2O4的质量为__________g(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-氨基-3硝基苯甲醚是合成类风湿关节炎治疗药物艾拉莫德的主要原料。4-氨基-3-硝基苯甲醚的合成路线如下:
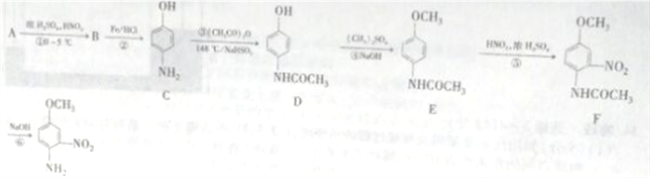
已知: NH2(有弱碱性,易被氧化)
NH2(有弱碱性,易被氧化)
回答下列问题:
(1)A的结构简式为_______________,B的名称是_______________。
(2)反应②的反应类型是____________。
(3)C中官能团的名称是_________________。
(4)写出反应③的化学方程式:________________,反应③温度较高,若不加NaHSO3会导致反应混合体系的颜色明显不同,可能的原因是________________。
(5)写出反应⑥的化学方程式:______________________。
(6)H是E的同分异构体,则满足下列条件的结构有____种(不考虑立体异构),其中核磁共振氢谱中有4组峰,且峰面积比为1:2:2:6的结构简式为_____________。
①含有 结构且能发生银镜反应
结构且能发生银镜反应
②N原子直接与苯环相连,且结构中不存在N—O键;
③苯环上有两个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某组同学为探究草酸浓度对该反应速率的影响,设计下列对照实验:
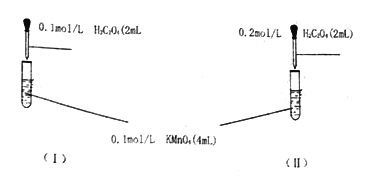
(1)写出上述反应的离子方程式____________。
(2)根据所学知识,你预期的实验现象是:_______(填“l”或“Ⅱ”)中紫色先褪去
(3)实验时,他们发现反应速率的变化从开始后的一段时间内,变化趋势如图,已知反应过程中温度基本不变,分析:
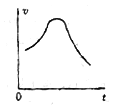
① 反应开始时,速度加块的原因为________;
② 后期反应速度下降的原因为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com