
| A.达平衡后,隔板K最终停留在左侧刻度0~2之间 |
| B.若平衡时K停留在左侧1处,则活塞停留在右侧6处 |
| C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量 |
| D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |

 2C(g),由于甲中充入2 mol A和1 mol B,反应向正反应方向移动,A中压强降低,最多能转化为2 mol C,但是由于反应是可逆反应,所以C的物质的量在0-2 mol之间,所以达到平衡后,隔板K不再滑动,最终停留在左侧刻度0-2之间,故A正确;
2C(g),由于甲中充入2 mol A和1 mol B,反应向正反应方向移动,A中压强降低,最多能转化为2 mol C,但是由于反应是可逆反应,所以C的物质的量在0-2 mol之间,所以达到平衡后,隔板K不再滑动,最终停留在左侧刻度0-2之间,故A正确;

科目:高中化学 来源:不详 题型:多选题
A. | B. | C. | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
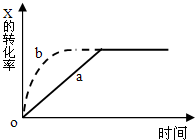
| A.升高温度 | B.加大X的投入量 |
| C.增加N的量 | D.缩小容器的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4molA+2molB |
| B.3molC+1molD+2molA+1molB |
| C.3molC+1molD+1molB |
| D.3molC+1molD |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=______.
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=______.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.如果继续通入一定量某气体使体系压强增大,平衡将正向移动 | ||
B.此时,X的正反应速率是Y的逆反应速率的
| ||
| C.如果降低温度,且保持物质状态不发生改变,混合气体的平均相对分子质量变小 | ||
| D.如果增加X的物质的量,平衡正向移动,X的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com