
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A.�����軯����Һ����Fe3+��Fe3++3SCN��![]() Fe��SCN��3��
Fe��SCN��3��
B.���ҽ���Һ�м���ϡ���ᡢ˫��ˮ��2I��+2H++H2O2![]() I2+2H2O
I2+2H2O
C.ĥ�ڲ����Լ�ƿ���ռ���Һ��ʴ��SiO2+2Na++2OH��![]() Na2SiO3��+H2O
Na2SiO3��+H2O
D.NaHCO3��Һ������Ba��OH��2��Һ��ϣ�+OH��+Ba2+![]() H2O+BaCO3��
H2O+BaCO3��
 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʰ��ᡢ��η�������������ȷ����
A. ���ᡢ���ʯ��ʯ B. �����ᡢ�ռ�̷�
C. ʯ̿�ᡢ��ʯ�ࡢ������ D. ���ᡢ�Ҵ��ơ����Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ȫȼ��0.1 molij����ȼ�ղ�������ͨ��Ũ���ᡢŨ��Һ��ʵ������Ƶ�Ũ��������9 g��Ũ��Һ����17.6 g�������Ļ�ѧʽΪ______����д�������п��ܵĽṹ��ʽ��__________________��
��2��ij��������Է�������Ϊ128���������Ļ�ѧʽΪ__________________��
��3����120 ���101 kPa�������£�ij��̬����һ��������������ϣ���ȼ��ȫ��Ӧ���ٻָ���ԭ�����¶�ʱ�������������������������ڵ���ԭ�Ӹ���______��
A����4 B������4
C������4 D�����ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ڼӳɷ�Ӧ����( )
A����Ȳͨ�����Ը��������Һ��,��Һ��ɫ
B����������ˮ��,����ˮ��ӽ���ɫ
C����֬��������Ӧ
D�����ѻ���õ����͵�����ˮ��,��ˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ���������������ͬһ��������Ԫ�أ�W��X�ǽ�����Y��Z�Ƿǽ���Ԫ�ء���ش��������⣺
��1��W��X���Ե�����������Ӧ��ˮ������Է�Ӧ�����κ�ˮ���÷�Ӧ�����ӷ���ʽΪ______��
��2��W��Y���γɻ�����W2Y���û�����ĵ���ʽΪ______________��
��3��Y�ĵͼ�������ͨ��Z���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪ______________��
��4��W��X��Y��Z����Ԫ�ؼ����ӵ����Ӱ뾶�ɴ�С��˳����___>____>____>____��
��5��Z�����������Ϊ��ɫҺ�壬��������ˮ�ɷ�����Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2013��12��17��,�й�������Դ���ٿ����ŷ�����,�����ڹ㶫�غ��齭����ض��������״����ߴ��ȿ�ȼ������ȼ������Ҫ�ɷ��Ǽ���,�����������ȼ��,Ҳ����Ҫ�Ļ���ԭ�ϡ�
��1������Ͷ�����̼�����ƺϳ���,����������������������ش����塣
��֪:CH4��g��+CO2��g��![]() 2CO��g��+2H2��g����H=+247.3 kJ��mol-1
2CO��g��+2H2��g����H=+247.3 kJ��mol-1
CH4��g��![]() C��s��+ 2H2��g�� ��H=+75 kJ��mol-1
C��s��+ 2H2��g�� ��H=+75 kJ��mol-1
����Ӧ2CO��g��![]() C��s��+CO2��g����һ�����������Է����е�ԭ���� ��
C��s��+CO2��g����һ�����������Է����е�ԭ���� ��
���ϳɼ״�����Ҫ��Ӧ��:2H2��g��+CO��g��![]() CH3OH��g����H=-90.8 kJ��mol-1,T ���´˷�Ӧ��ƽ�ⳣ��Ϊ160��ijʱ�̲�ø���ֵ�Ũ������:
CH3OH��g����H=-90.8 kJ��mol-1,T ���´˷�Ӧ��ƽ�ⳣ��Ϊ160��ijʱ�̲�ø���ֵ�Ũ������:
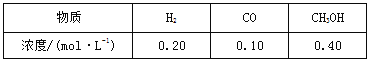
�Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С:v������ v�����������������������=����������������,�ϳ���Ҫ����ѭ��,��Ŀ���� ��
����һ�����ܱ�������,Ҫ��߷�Ӧ2H2��g��+CO��g��![]() CH3OH��g����CO��ת����,���Բ�ȡ�Ĵ�ʩ�� ��
CH3OH��g����CO��ת����,���Բ�ȡ�Ĵ�ʩ�� ��
a.����
b.�������
c.����CO��Ũ��
d.����H2
e.�����������
f.������״�
��2���Լ���Ϊȼ�ϵ����͵��,��ɱ�����������Ϊȼ�ϵĴ�ͳȼ�ϵ��,��ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ��
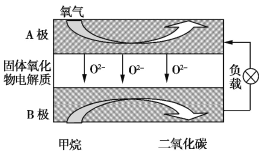
��B��Ϊ��� ��,�缫��ӦʽΪ ��
�����ø�ȼ�ϵ������Դ,��ʯī���缫���100 mL 1 mol/L������ͭ��Һ,�������ռ���������������ʱ,���������ļ�������Ϊ �����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ����ѧ������(ѡ��1)��ѡ������
��1����Դ����Ҫ����ʹ�á�
��ˮ��һ�ֱ������Դ������ˮ��Դ���DZ������ǵ���������������������ˮ��Դ��������______(����ĸ����)
A����ѧ����ʹ��ũҩ B�������ŷŻ�������ˮ C������������ˮ������ŷ�
����Ȫˮƿ�������ⶪ���������������������Ȫˮƿ����_____________(��ɻ�����ɶѷ�������)��
��������β��ϵͳ�а�װ��ת����������Ч����β����CO��NO����������ŷţ���С������Ⱦ���ڴ�ת�����У�CO��NO������Ӧ������ɸ÷�Ӧ�Ļ�ѧ����ʽ_____________��
��2���������������������ѳ�Ϊ���ǵĹ�ͬ������
�����dz��ڹ��������������б�־���������ڻ��ձ�־����__________
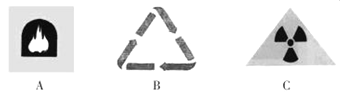
��2014��1�£��������涨��ѧУ����������ֹ���̡������й�˵���У�����ȷ����____________��
A�����̻�����ں������������Ⱦ
B�����뽹�͡���Ŷ���������ɵ��¶��ֲ���
C��N2��CO2��CO��Ŷ��Ͷ��������ڿ�����Ⱦ��
��3����ѧ�������ϵ���С����������������ʣ�
A�������� B���������� C��ά����C D����֬
��__________����Ҫ��������Դ��
��__________�㷺����������ˮ������ɫ�߲��У������Ժͻ�ԭ�ԣ��ֳ�Ϊ����Ѫ�
��4��������������������ͷ�չ����Ҫ���ʻ���
���Թܡ��ձ�����ƿ�Ȼ�ѧ��������Ҫ������__________��
A������ B���մ� C��ˮ��
���������š���ĸ�ķ��۾�����Ŀ�����������캽ĸ����Ҫ���ϡ������ֳɷ��ϵ���Ҫ�����_________��
A��̼�ĺ�����ͬ
B���ס���ĺ�����ͬ
C���������Ƚ���������ͬ
�������ڳ�ʪ����������������ʴ��������ӦʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽����ҵ���ϵ������ã�ij��ѧ��ȤС�����������ʵ�����̣��ú�����������ͭ�ĺϽ������ȡ��ˮ�Ȼ������̷�����(FeSO47H2O)�͵������塣
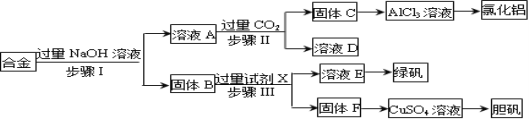
��ش�
���Ʊ���ˮ�Ȼ�����
��1���������е�ʵ���������Ҫ�IJ��������� ��
��2����������ɹ���C�����ӷ���ʽ�� ��
��3�����в����ʱ����С��������ͼ��ʾװ�ü��Լ���ȡCO2�����Ƶõ�����ͨ����ҺA�С�һ��ʱ��۲쵽�ձ��в����İ�ɫ���������١�Ϊ�˱������C���٣��ɲ�ȡ�ĸĽ���ʩ�� ��
��4����AlCl3��Һ�Ʊ���ˮAlCl3��ʵ��������£�
����AlCl3��Һ�Ʊ��Ȼ������壨AlCl36H2O���漰�IJ���Ϊ�� ����ȴ�ᾧ��������ϴ�ӣ�
�ڽ�AlCl36H2O����Ũ����������������õ�һ��������ˮAlCl3����ԭ��������Ũ�������������е� ������ĸ����
a�������� b����ˮ�� c���ѻӷ��� d����ˮ��
���Ʊ��������塿
��5���ù���F�Ʊ�CuSO4��Һ���������������;��������Ϊ�����;��Ϊ �����������


���ⶨFeSO47H2O������
��6����ȡ�Ƶõ��̷���Ʒ10.0 g������������ϡ�����У����100 mL��Һ��ȷ��ȡ25.00 mL��Һ������ƿ�У�����0.1000 mol/L KMnO4����Һ�ζ�����ͬ���ķ����ζ�3�Σ�ƽ������15.00 mL��Һ������Ʒ��FeSO47H2O����������Ϊ ������֪Mr(FeSO4��7H2O)=278��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽΪ��HO-CH2-CH2-COOH������һ����Ҫ���л�����ԭ�ϣ���һ��������������ת�����е���������ʡ�ԣ���
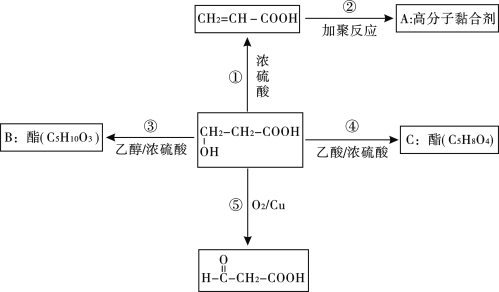
��ش�
��1��C�Ľṹ��ʽΪ________________��
��2����Ӧ�ڡ��ݵĻ�ѧ����ʽΪ����_________________________����_________________________
�۵ķ�Ӧ����______________________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com