
【题目】X、Y、Z、W、Q是短周期原子序数依次增大的五种元素。X是形成化合物种类最多的元素,Y和Z形成的化合物给大气造成各种危害.室温下0. 01 mol/L的W的最高价氧化物的水化物的溶液的pH=12,Q元素形成的单质在常温下是黄绿色气体。
(1)写出Y元素形成的单质的电子式: _______________ .
(2)Z、W、Q三种元素分别对应的简单离子半径最小的是___________(填离子符号)。
(3)QZ2是一种橙黄色的易爆气体,当发生泄漏和爆炸事故,人们逃离爆炸现场时,可用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子, 最适宜采用的物质是_______ (填字母代号)。
A. NaOH B. NaCl C. KC1 D. Na2CO3
(4)X、Y、W三种元素可以形成一种有剧毒的盐,用QZ2可以除去水溶液中含有的该有毒物质,得到一种生活中常见的固体和两种无毒气体. 写出该反应的离子方程式:__________________。
【答案】![]() O2- D 2ClO2 + 2CN- = 2Cl- + 2CO2↑ + N2↑
O2- D 2ClO2 + 2CN- = 2Cl- + 2CO2↑ + N2↑
【解析】
X是形成化合物种类最多的元素,X为C;0. 01 mol/L的W的最高价氧化物的水化物的溶液的pH=12,短周期中一元强碱为氢氧化钠,W为Na;Q元素形成的单质在常温下是黄绿色气体,Q为Cl;X、Y、Z、W、Q是短周期原子序数依次增大,Y、Z元素在碳和钠之间,并形成的化合物给大气造成各种危害,因此Y和Z形成的化合物为氮氧化物,因此Y为N;Z为O;
(1)Y为氮元素,单质为氮气,电子式为![]() ;
;
答案为:![]() ;
;
(2)Z、W、Q三种元素分别对应的简单离子分别为O2-、Na+、Cl-,Cl-核外为三层电子,O2-、Na+核外两层电子,Cl-半径最大,电子层结构相同的,核电荷数越大,半径越小,半径最小的是O2-。
答案为:O2-;
(3)A.NaOH是强碱,腐蚀性强,故A错误;
B.NaCI不能吸收CIO2,故B错误;
C.KCI不能吸收CIO2,故C错误;
D.Na2CO3碱性较弱,能吸收CIO2,所以最适宜采用的物质是碳酸钠,故D正确;
答案选D。
(4)X、Y、W三种元素可以形成一种有剧毒的盐为氰化钠,用QZ2可以除去水溶液中含有的该有毒物质,得到一种生活中常见的固体和两种无毒气体,即氰化钠与二氧化氯反应生成氯化钠、二氧化碳和氮气。离子反应方程式为2ClO2 + 2CN- = 2Cl- + 2CO2↑ + N2↑
答案为:2ClO2 + 2CN- = 2Cl- + 2CO2↑ + N2↑;


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某化学兴趣小组测定其中NH4HCO3的含量。小组的同学设计用在混合物中加酸的实验方法来测定其中NH4HCO3的质量分数。(SO2与酸性KMnO4的反应原理:SO2+MnO4-+H+—SO42-+Mn2++H2O)回答以下问题:
(1)化学小组要紧选用了以下药品和仪器进行实验(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)
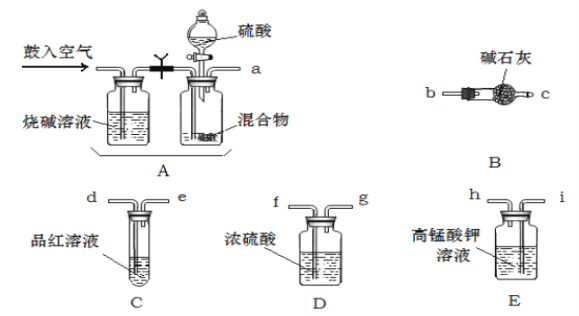
请按气流由左向右的方向,仪器连接顺序是〔填仪器的接口字母a、b...)a→_______f→g→_______。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,作用是;加酸后A装置再次鼓入空气的作用是_______。
(3)E装置的作用是:_______。
(4)实验中,假设C试管中溶液褪色,那么测定结果可能会偏_______,为了确保实验中C试管中溶液不褪色,假设取样品的质量为mg,实验前E中所装amol·L-1的KMnO4溶液体积〔V〕应多于______mL;
(5)假设混合物样品质量为9.875g,充分作用后碱石灰增重4.4g,那么混合物中NH4HCO3的质量分数为_______。
(6)从定量测定的准确性的角度考虑,该套装置还应作进一步的改进,改进的措施是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机A是衡量一个国家石油化学工业的发展水平,D的分子式为C2H5Cl,C是一种常见的高分化合物。请回答下列问题:
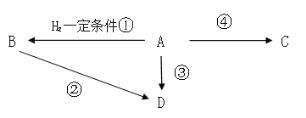
(1)写出A的结构式___;
(2)写出②的方程式___;途径②、③都可以得到D,更合理的是途径___,理由是___;
(3)写出区别A、B两种物质的一种试剂___;
(4)写出④的方程式___;
(5)体育比赛中,当运动员扭伤或肌肉挫伤时,队医随即对准运动员的受伤处喷射液体D(沸点12.27℃)进入局部冷冻麻醉处理,原理是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钨(WS,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2()3)制备二硫化钨的工艺流程如图所示,下列说法正确的是
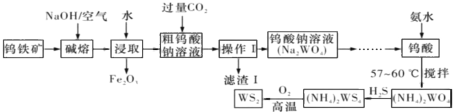
A.操作I中用到的玻璃仪器只有漏斗、烧杯
B.FeWO4在碱熔过程中发生反应的化学方程式为4FeWO4+O2+8NaOH![]() 2Fe2O3+4NaWO3+4H2O
2Fe2O3+4NaWO3+4H2O
C.生成二硫化钨的化学方程式为(NH4)2WS4+3O2![]() 2WS2+4NH3+2S2-+2SO2+2H2O,若生成124g WS2,则该反应所转移的电子数目为2NA
2WS2+4NH3+2S2-+2SO2+2H2O,若生成124g WS2,则该反应所转移的电子数目为2NA
D.滤渣I的主要成分是氢氧化铝,CO2可以用过量盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
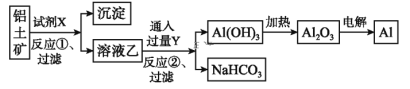
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com