
分析 (1)N2H62+所带正电荷数大于N2H5+,更易结合水电离出的带负电的OH-,水解程度更大;
(2)次氯酸钠的还原产物为氯化钠,不是氯气,还有水生成,氯化钠、水对环境都友好,结合原子守恒配平书写得到化学方程式;
(3)①反应I是吸热反应,反应II是放热反应;
②根据盖斯定律知,反应I×7+反应II×4=反应III;
(4)N2H4/空气在碱溶液中构成电池,N2H4在负极上发生氧化反应,O2在正极上发生还原反应,负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O,镀镍时阴极的反应式为Ni2++2e-=Ni,镍的相对原子质量为59,阳极为纯镍,阳极的电极反应式为Ni-2e-=Ni2+,根据得失电子守恒建立关系计算.
解答 解:(1)相同温度下,上述平衡常数K2<K1,其主要原因是N2H62+所带正电荷数大于N2H5+,更易结合水电离出的带负电的OH-,水解程度更大,
故答案为:N2H62+所带正电荷数大于N2H5+,更易结合水电离出的带负电的OH-,水解程度更大;
(2)次氯酸钠的还原产物为氯化钠,不是氯气,还有水生成,氯化钠、水对环境都友好,化学方程式为:NaClO+2NH3=NaCl+N2H4+H2O,
故答案为:NaClO+2NH3=NaCl+N2H4+H2O;
(3)①反应I是吸热反应,△H1>0,反应II是放热反应,△H2<0,则△H1>△H2,
故答案为:>;
②反应I:N2H4(g)?N2(g)+2H2(g)△H1
反应II:N2(g)+3H2(g)?2NH3(g)△H2
反应III:7N2H4(g)?8NH3(g)+3N2(g)+2H2(g)△H
根据盖斯定律知,反应I×7+反应II×4=反应III,△H=7△H1+4△H2,
故答案为:7△H1+4△H2;
(4)N2H4/空气在碱溶液中构成电池,N2H4在负极上发生氧化反应,O2在正极上发生还原反应,负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O,
镀镍时阴极的反应式为Ni2++2e-=Ni,镍的相对原子质量为59,阳极为纯镍,阳极的电极反应式为Ni-2e-=Ni2+,设至少消耗N2H4的物质的量为n,由电子守恒知,阴极质量与阳极质量之差为[2n-(-2n)]×59g/mol=1.18g,n=0.005mol,m(N2H4)=0.005mol×32g/mol=0.16g,
故答案为:N2H4-4e-+4OH-=N2↑+4H2O;0.16.
点评 本题考查较为综合,涉及反应速率、平衡移动、盖斯定律以及电化学等知识,题目难度中等,注意把握影响平衡移动的因素以及平衡移动方向的判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
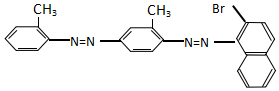
| A. | 不能发生加成反应 | B. | 属于甲苯同系物 | ||
| C. | 属于芳香烃 | D. | 能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径X>Y>Z | |
| B. | 离子半径Ym->Xn+>Zm+ | |
| C. | 三种元素最高价氧化物对应水化物碱性依次减弱,酸性依次增强的顺序是X,Z,Y | |
| D. | Y在自然界中没有游离态,可形成原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
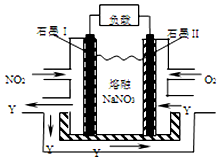 汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.| 实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐和醋可作调味剂,也可用作食品防腐剂 | |
| B. | 植物秸秆不可用来制造酒精 | |
| C. | 镁合金可用于制造火箭、导弹和飞机的部件 | |
| D. | 二氧化硅可用于制光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com