
 丁醇,查阅资料得知一条合成路线:
丁醇,查阅资料得知一条合成路线: CH2+CO+H2
CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO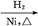 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;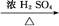 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。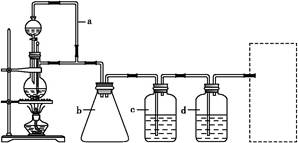
 丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。
丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。  丁醇粗品。为纯化1
丁醇粗品。为纯化1 丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)
丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和) RCH(OH)SO3Na↓;②沸点:乙醚34℃,1
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1 丁醇 118℃,并设计出如下提纯路线:
丁醇 118℃,并设计出如下提纯路线: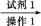 滤液
滤液
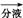 有机层
有机层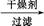 1
1 丁醇、乙醚
丁醇、乙醚 纯品
纯品 ZnCl2+H2↑
ZnCl2+H2↑
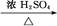 CH3CH
CH3CH CH2↑+H2O
CH2↑+H2O
 丙醇和浓硫酸共热,消去反应制备丙烯;(2)在题给装置中,a的作用是保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O(g),试剂选用浓硫酸;若用题给装置制备H2,则不需要酒精灯,必须是反应容器和滴加盐酸的仪器,氢气用向下排空气法收集,注意导气管伸入底部;(3)检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用⑤品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2;然后用③石灰水检验CO2,用②酸性KMnO4溶液检验丙烯,应该先除尽SO2,因为丙烯和SO2都能使酸性KMnO4褪色;(4)题给合成正丁醛的反应为气体体积减小的放热反应,为增大反应速率和提高原料气的转化率,选b;(5)由操作1后得到“滤液”和信息①可知,试剂1应为NaHSO3饱和溶液,操作为过滤;加入乙醚时1
丙醇和浓硫酸共热,消去反应制备丙烯;(2)在题给装置中,a的作用是保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O(g),试剂选用浓硫酸;若用题给装置制备H2,则不需要酒精灯,必须是反应容器和滴加盐酸的仪器,氢气用向下排空气法收集,注意导气管伸入底部;(3)检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用⑤品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2;然后用③石灰水检验CO2,用②酸性KMnO4溶液检验丙烯,应该先除尽SO2,因为丙烯和SO2都能使酸性KMnO4褪色;(4)题给合成正丁醛的反应为气体体积减小的放热反应,为增大反应速率和提高原料气的转化率,选b;(5)由操作1后得到“滤液”和信息①可知,试剂1应为NaHSO3饱和溶液,操作为过滤;加入乙醚时1 丁醇易溶解于其中,故操作2为萃取分液;根据两种有机物沸点的不同,操作3应为蒸馏。
丁醇易溶解于其中,故操作2为萃取分液;根据两种有机物沸点的不同,操作3应为蒸馏。

科目:高中化学 来源:不详 题型:单选题
| A.除去NaCl溶液中少量CaCl2:加入适量Na2CO3,过滤 |
| B.用酒精可以从碘水中萃取碘 |
| C.Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯 |
| D.用品红溶液或酸性KMnO4溶液鉴别 CO2和SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,沉淀不溶解,则该溶液中一定含有SO42- |
| B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中至少有SO32-和CO32-中的一种 |
| C.取少量Na2SO3样品于试管中加水溶解后加入盐酸有气体产生,再加入BaCl2溶液有白色沉淀产生,说明Na2SO3样品已部分被氧化 |
| D.能使湿润的淀粉碘化钾试纸变蓝的一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
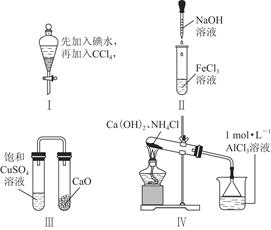
| A.实验Ⅰ:振荡后静置,液体分层,下层液体无色 |
| B.实验Ⅱ:滴入氢氧化钠溶液后,试管中出现白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色 |
| C.实验Ⅲ:一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
| D.实验Ⅳ:加热后,水槽中先生成白色沉淀,后逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
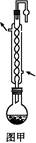
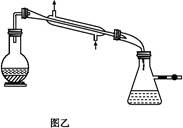
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
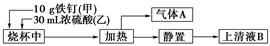
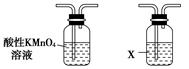

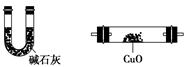
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
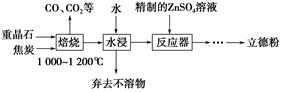
 BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 混合物 | 试剂 | 分离方法 |
| A | Fe(碘) | — | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com