
【题目】常温下,甲酸和乙酸的电离常数分别为1.8×10-4和1.8×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。两种酸用通式HY表示,下列叙述正确的是
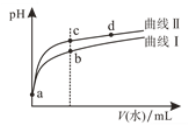
A.曲线Ⅱ代表乙酸
B.酸的电离程度:c点>d点
C.溶液中水的电离程度:b点>c点
D.从c点到d点,溶液中![]() 保持不变
保持不变
科目:高中化学 来源: 题型:
【题目】某有机物W的结构简式为![]() 下列有关W的说法错误的是
下列有关W的说法错误的是
A.是一种酯类有机物B.含苯环和羧基的同分异构体有3种
C.所有碳原子可能在同一平面D.能发生取代、加成和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素形成的某种化合物(如图所示)是一种优良的防龋齿剂(用于制含氟牙膏)。下列说法错误的是( )
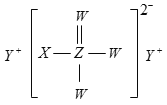
A.W、X、Y的简单离子的电子层结构相同
B.W、Y形成的化合物中只含离子键
C.该化合物中Z不满足8电子稳定结构
D.X、Y形成的化合物溶于水能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为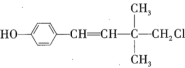 ,下列关于该有机物的说法错误的是( )
,下列关于该有机物的说法错误的是( )
A.有顺反异构B.可以和浓溴水发生取代反应和加成反应
C.可以发生加聚反应、水解反应和消去反应D.1mol该有机物最多能与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院将2019年度诺贝尔化学奖授予美国JohnBGoodenough教授、M.stanleyWhittlingham教授和日本化学家AkiraYoshino,以表彰其在锂离子电池的发展方面作出的贡献。
(1)基态锂原子核外能量最高的电子所处能级的电子云轮廓图的形状为___;基态磷原子第一电离能比硫的___ (填“大”或“小”),原因是___。
(2)实室中可用KSCN或K4[Fe(CN)6]来检验Fe3+,FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是___;
(3)磷酸(H3PO4)和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为___;亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,则H3PO3的结构式为___。
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
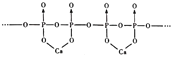
由图推知该多磷酸钙盐的通式为__(用n表示重复单元数)
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为__;Fe2+与O2-最短核间距为___pm。
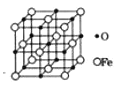
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,在20.0mL 0.10mol/LH2SO4溶液中滴入0.10 mol/L的NaOH溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列叙述正确的是
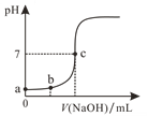
A.滴定过程最好用甲基橙作指示剂
B.a点溶液的pH=1.0
C.b点溶液中c(H+)=0.05mol/L
D.c点对应的NaOH溶液体积为20.0mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山豆根查尔酮具有清热解毒的作用。下列说法错误的是( )
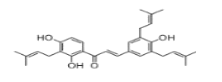
A.它的化学式为C30H34O4。
B.分子中所有的C原子可能共面。
C.1mol山豆根查尔酮最多消耗NaOH、H2的物质的量分别为3mol、11mol。
D.可以用浓溴水检验山豆根查尔酮的存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知:甲醇分解反应:CH3OH(g)![]() CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g)
CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g)
CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为_________________________。
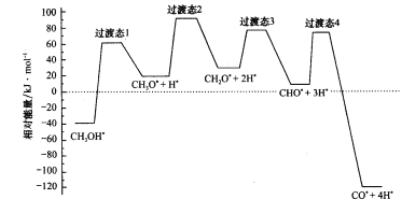
(3)在0.1MPa下,将总进料量1 mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
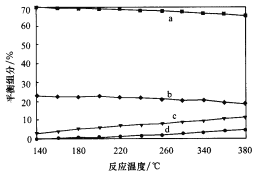
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是__________。
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,试解释a的含量约是c的含量3倍的原因__________。
(4)297 K时,向密闭容器Ⅰ(体积为4L)和Ⅱ(体积为8L)中分别充入下列物质发生反应,
编号 | CO(mol) | H2(mol) | CH3OH(mol) |
Ⅰ | 4 | a | 0 |
Ⅱ | 4 | 4 | 4 |
达平衡时两个容器中c(H2)相等且c(H2)=0.5mol/L。则
①a=_____________。
②该温度时,Ⅰ中反应的K=___________。
③Ⅱ中按表格数据充入反应物此时反应的方向__________(填“正向进行”、“平衡”或“逆向进行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As的第一电离能由大到小的顺序为___;基态As原子的核外电子排布式为___。
(2)NH3的沸点比PH3的___(填“高”或低”),原因是___。
(3)Na3AsO4中含有的化学键类型包括___,AsO43-的空间构型为___。
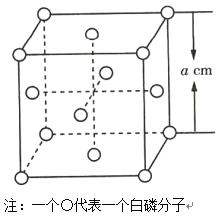
(4)白磷(P4)晶体属于分子晶体,其晶胞结构如图所示(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为___,该晶胞的密度为___g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com