
【题目】在生产生活中,下列不属于化学变化的是( )
A.用海带提取碘单质B.用铝热反应焊接铁轨
C.用石油分馏得汽油D.蛋白质变性
科目:高中化学 来源: 题型:
【题目】图表示某反应的能量变化,对于该图的理解,你认为一定正确的是:

A. 曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化
B. 曲线Ⅱ可表示反应2KClO3![]() 2KCl+3O2↑的能量变化
2KCl+3O2↑的能量变化
C. 该反应不需要加热条件就一定能发生
D. 该反应的ΔH=E2-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是人体细胞中三种重要有机物A、C、E的元素组成及相互关系图,请据图回答:

(1)图中X所指的元素为________。
(2)A的中文名称为____________,其彻底水解的产物有___种。
(3)细胞结构Ⅱ的名称为________,在细胞中分布场所为________,主要作用有__________、______。
(4)过程②叫做________,若b的平均相对分子质量为r,通过②反应过程形成m条肽链,经盘曲折叠构成相对分子质量为e的E,则E分子中肽键的数目是________。E具有多样性,其原因由b分析为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为H2SO4溶液,则氢氧燃料电池的正极反应式为__________________________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积不变的密闭容器中发生化学反应:2A(g) ![]() B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:

则下列有关说法中正确的是
A. 条件I、条件II时的反应温度不同,压强相同
B. 条件I时可能未使用催化剂,条件II时可能使用了催化剂
C. 条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D. 条件IV和条件II相比较,条件IV时可能缩小了容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应过程中能量变化的说法正确的是

A. 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化
B. 己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
C. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D. 在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关浓硫酸、浓盐酸、浓硝酸的认识不正确的是
A.浓硫酸、浓硝酸与金属反应时,分别是S、N得电子
B.蔗糖与浓硫酸混合后,白色蔗糖固体逐渐变成黑色疏松的碳,体现了浓硫酸的脱水性
C.浓盐酸、浓硝酸具有挥发性,而浓硫酸难挥发
D.常温下,浓硫酸或浓HNO3中投入Fe片,均会产生大量的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别用下图所示的三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:
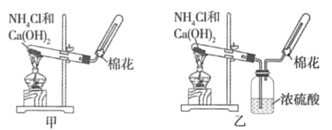
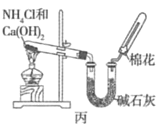
(1)三位同学制取氨气的化学方程式为__________。
(2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是__________(填序号)。
A.氨气难溶于水 B.氨气极易溶于水
C.氨气密度比空气大 D.氨气密度比空气小
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(他们的实验操作都正确),你认为没有收集到氨气的同学是__________(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是__________________________。
(4)检验氨气是否收集满的方法是__________(填序号)。
A.闻到有氨气逸出 B.用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
C.棉花被气体冲出 D.用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的同学是__________(填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体中可能含有Na+、K+、Mg2+、Ba2+、 SO42-、CO32-、SO32-、SiO32-等离子,将其配成100mL溶液。学生研究性学习小组为了确认其成分,设计并完成了如图所示实验:

请回答下列问题:
(1)实验中最关键的“定容”操作:当液面接近容量瓶刻度线1-2cm处,________再将容量瓶塞盖好,反复上下颠倒,摇匀。
(2)根据以上实验可得出:一定存在的离子是________,一定不存在的离子是________
(3)下列实验结论符合事实的是________________
A.该固体中可能含有Na2SiO3、K2CO3
B.该固体中一定含有Na2SiO3、K2CO3
C.该固体中可能含有Na2SiO3、K2CO3、K2SO4
D.该固体中可能只含有Na2SiO3、Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com