
| A. | 金属钠投入CuSO4溶液中 | B. | 过量的NaOH溶液和明矾溶液反应 | ||
| C. | 金属钠投入MgSO4溶液中 | D. | 金属铝投入NaOH溶液中 |
分析 A.金属钠投入CuSO4溶液中,钠与水反应,产物氢氧化钠与CuSO4反应;
B.过量的NaOH溶液和明矾溶液反应生成偏铝酸钠;
C.金属钠投入MgSO4溶液中,钠与水反应,产物氢氧化钠与MgSO44反应;
D.金属铝投入NaOH溶液中,生成偏铝酸钠.
解答 解:A.钠浮与水剧烈反应,生成氢氧化钠和氢气,发生2Na+H2O=2NaOH+H2↑、氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀,2NaOH+CuSO4=Na2SO4+Cu(OH)2↓,既有气体生成最终又有蓝色沉淀生成,故A不选;
B.过量的NaOH溶液和明矾溶液反应的方程式KAl(SO4)2•12H2O+4NaOH=KAlO2+14H2O+2Na2SO4,没有无沉淀生成,故B不选;
C.钠浮与水剧烈反应,生成氢氧化钠和氢气,发生2Na+H2O=2NaOH+H2↑、氢氧化钠与硫酸镁反应生成氢氧化铜白色沉淀,2NaOH+MgmSO4=Na2SO4+Mg(OH)2↓,既有气体生成最终又有白色沉淀生成,故C选;
D.金属铝投入NaOH溶液中,生成偏铝酸钠,反应中没有沉淀生成,故D不选.
故选C.
点评 本题主要考查了元素钠、铝、硫、铁的化合物的性质,要求掌握这些化合物的一些重要的化学反应方程式,并理解为什么会发生,从而运用这些反应解相关的问题,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 1 g H2含有的氢原子数目为2NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 L 1 mol•L-1 KOH溶液中含有的钾离子数目为NA | |
| D. | 1 mol Zn变为Zn2+失去的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使石蕊试液变红的溶液中:Na+、K+、Br-、SO42- | |
| B. | 氯化亚铁溶液中:K+、Al3+、SO42-、MnO4- | |
| C. | 硫酸铝溶液中:K+、AlO2-、Na+、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:NH4+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
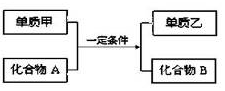
 ,在这个反应中作氧化剂的是H2O(填化学式)
,在这个反应中作氧化剂的是H2O(填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 通入氯化氢气体 | ||
| C. | 加入适量的氢氧化钠溶液 | D. | 加入固体AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙苯和邻二甲苯属于同分异构体 | |
| B. | 苯和苯乙烯属于同系物 | |
| C. | 糖类和蛋白质都属于天然高分子化合物 | |
| D. | 植物油和矿物油都属于油脂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com