
【题目】某校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____。滴定终点的现象是____________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为____mL。

(4)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | |||
第1次 | 20.00 | 0.00 | 26.01 | |
第2次 | 20.00 | 1.56 | 30.30 | |
第3次 | 20.00 | 0.22 | 26.21 | |
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量。(写出计算过程)__
【答案】锥形瓶内溶液颜色变化 由黄色变成橙色,且半分钟不褪色 D 26.10 26.00×10-3L×0.1000mol/L×40g/mol×50/5.360g=97.01%
【解析】
(1)滴定时要根据锥形瓶中溶液颜色变化判断终点;溶液为黄色,达到终点时变为橙色;
(2)根据C(待测)═![]() 分析;
分析;
(3)由图可知滴定前读数为0.00mL,滴定后读数为26.10mL;
(4)第二次实验数据误差太大,舍去,求出第一、三次实验的平均值;计算C(待测)═![]() ,再根据C(待测)计算样品中NaOH的质量百分含量。
,再根据C(待测)计算样品中NaOH的质量百分含量。
(1)滴定时要根据锥形瓶中溶液颜色变化判断终点,所以眼睛应该观察锥形瓶内溶液颜色变化;滴定前锥形瓶中为氢氧化钠和甲基橙,溶液为黄色,达到终点时变为橙色,则滴定终点的现象是溶液由黄色变成橙色,且半分钟不褪色;
答案:锥形瓶内溶液颜色变化 由黄色变成橙色,且半分钟不褪色
(2)根据c(待测)═![]() 分析,V(标准)高,则偏高,V(标准)低,则偏低;
分析,V(标准)高,则偏高,V(标准)低,则偏低;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成消耗的V(标准)偏大,则测定c(NaOH)偏高,故A不符合;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,测定c(NaOH)无影响,故B不符合;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,测定c(NaOH)偏高,故C不符合;
D.读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,测定的c(NaOH)偏低,故D符合;
答案:D
(3)由图可知滴定前读数为0.00mL,滴定后读数为26.10mL;
答案: 26.10
(4)第二次实验数据误差太大,舍去,求出第一、三次实验的平均值为![]() =26.00mL,则c(待测)═
=26.00mL,则c(待测)═![]() =
=![]() =0.13mol/L,则1000.0ml溶液中氢氧化钠为n=cV=0.13mol/L×1L=0.13mol,所以m(NaOH)=nM=0.13mol×40g/mol=5.2g,该样品中NaOH的质量百分含量为
=0.13mol/L,则1000.0ml溶液中氢氧化钠为n=cV=0.13mol/L×1L=0.13mol,所以m(NaOH)=nM=0.13mol×40g/mol=5.2g,该样品中NaOH的质量百分含量为![]() ×100%=97.01%;
×100%=97.01%;
计算过程简写: 26.00×10-3L×0.1000mol/L×40g/mol×1000/(20×5.360g)=26.00×10-3L×0.1000mol/L×40g/mol×50/5.360g=97.01%
答案: 26.00×10-3L×0.1000mol/L×40g/mol×50/5.360g=97.01%


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,阅读表格回答问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素③的原子序数为___________,被选做相对原子质量标准的核素是___________(填核素符号);
(2)①与②、③、④、⑦、⑧形成的化合物中,最稳定的是___________(填化学式);表中所示元素最高价氧化物对应的水化物中酸性最强的是___________(填化学式);
(3)请画出元素④与⑤按原子个数比1︰1组成的淡黄色固体物质的化学式___________;
(4)请写出⑤的最高价氧化物对应水化物与⑥的单质反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,利用培养皿探究NH3的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝 | NH3是一种可溶性碱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡,下列说法正确的是( )
CH3OH(g)达到平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0.20 | 0.10 | 0 | 0.025 |
A. 该反应的正反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.用干燥的pH试纸测定氯水的pH
B.配制一定浓度的NaOH溶液,定容时仰视读数,使配制的溶液浓度偏小
C.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离
D.将25.0 g CuSO4·5H2O溶于100 mL蒸馏水中,配制100 mL 1.0 mol/L CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
B | 大试管中CH4和Cl2按照1∶1混合,放于光亮处 | 试管内气体颜色变浅,试管壁出现油状液滴,管中有白雾 | 光照条件下,CH4和Cl2发生了化学变化 |
C | 向20%蔗糖溶液中加入少量稀硫酸,加热,再加入新制氢氧化铜后再加热至沸腾 | 无明显现象 | 蔗糖未发生水解 |
D | 小块鸡皮上滴加3~5滴浓硝酸 | 鸡皮由白变黄 | 蛋白质都能发生颜色变化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )。
A.用浓盐酸与二氧化锰反应制取少量氯气:MnO2+4HCl![]() Mn2+ + 2Cl-+ Cl2↑+2H2O
Mn2+ + 2Cl-+ Cl2↑+2H2O
B.在NaHCO3溶液中滴加少量Ca(OH)2:![]() + Ca2+ + OH═ CaCO3↓+ H2O
+ Ca2+ + OH═ CaCO3↓+ H2O
C.氯气与水反应:Cl2 + H2O ═ 2H+ + Cl- +ClO-
D.NaClO溶液中通入少量的SO2:3ClO﹣+H2O+SO2═Cl﹣+![]() +2HClO
+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:
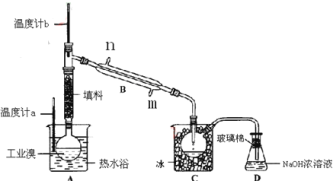
(1)装置B直形冷凝管进水方向______(填“Ⅱ”或“Ⅲ”),装置D的名称是_________。
(2)在A圆底烧瓶中加入一定量工业溴和2小片碎瓷片,加入碎瓷片的作用是_________;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是_______(填正确答案标号)。A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____________________。
(4)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:___________。
(5)装置C的作用:_____________________。装置D的作用是________________________。
(6)提纯液溴也要用到分液操作,分液漏斗在使用前须清洗干净并___________;用CCl4提取溴时,产物应该从分液漏斗的______________(填“上口倒出”或“下口放出”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com