
下列叙述中正确的是( )。
A.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
B.Na2O能继续被氧化成Na2O2
C.Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
D.Na2O2只有还原性
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如图所示的装置。
(1)检查图所示装置气密性的方法是________________________________________________。
(2)分别写出Al和Fe与硫酸反应的离子方程式
_____________________________ , _______________________。
(3)若要比较产生气体的快慢,可以测量相同时内产生气体的体积,也可以测量________________________________________。
 (4)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图所示,分析不同时间段速率变化的原因:
(4)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图所示,分析不同时间段速率变化的原因:
t1─t2 阶段速率加快的原因________________________。
t2─t3 阶段速率减慢的原因_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质浓度为c mol/L,则下列关系中不正确的是 ( )
A. ρ=(17V+22 400)/(22.4+22.4V)
B. w=17c/(1 000ρ)
C. w=17V/(17V+22 400)
D.c=1 000Vρ/(17V+22 400)
查看答案和解析>>
科目:高中化学 来源: 题型:
向0.1 mol·L NaOH溶液中通入过量CO2后,溶液中存在的主要离子是( )。
A.Na+、CO32- B.Na+、HCO3- C.HCO3-、CO32- D.Na+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一定量含有Na2O杂质的Na2O2试样,现从图中选用适当的装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物有CaCO3、约18%的盐酸和水)。

请填写下列空白:
(1)写出在实验中Na2O2和Na2O分别发生反应的化学方程式________,________。
(2)应选用装置(只要求写图中装置的标号)________。
(3)所选装置的连接顺序是(填各接口的字母,连接胶管省略)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中有100 g氧气和足量的过氧化钠,向其中充入5 g CO和H2的混合气体后,用电火花点燃,反应足够长时间后,容器内气体的质量为( )。
A.大于100 g B.小于100 g C.等于100 g D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
PM2. 5是指大气中直径小于或等于2.5微米的颗粒物,严重危害人体健康,也称为可入肺颗粒物。近年来我国PM2.5污染问题日益凸显。2013年南昌市开展PM2.5和臭氧监测,每天都公布空气质量级别。下面所列各项,在空气质量日报中完全正确的是( )
①可吸入颗粒物 ②总悬浮颗粒物 ③氢氧化物 ④二氧化碳 ⑤二氧化硫
⑥二氧化氮 ⑦一氧化碳 ⑧一氧化氮 ⑨氮气 ⑩臭氧
A.①③⑤⑦⑨ B.①⑤⑥⑦⑩ C.②③⑤⑥⑦ D.②④⑥⑦⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是
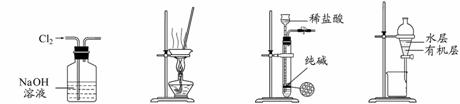
图1 图2 图3 图4
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
28(10分)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO。从中提 取钴的主要工艺流程如下:
取钴的主要工艺流程如下:

(1)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(2)“除钙、镁”的原理反应为:
MgSO4+2NaF=MgF2↓+Na2SO4,CaSO4+2NaF=CaF2↓+Na2SO4
已知KSP(CaF2)=1.11×10-10,KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中 。
。
(3)“沉淀”中含杂质离子主要有SO42-、F-、 和 ;“操作X”包括 和 。
(4)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是________
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu
 b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu
d.溶液中有Fe2+,不溶物为Cu、Al
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图所示)。电池反应为
 LiCoO2 + C6 CoO2 + LiC6 ,写出该电池放电时的正极反应式 。
LiCoO2 + C6 CoO2 + LiC6 ,写出该电池放电时的正极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com