
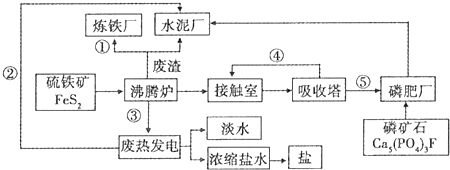
分析 (1)该产业链利用废热发电进行海水淡化、浓缩生成盐,而生成硫酸-磷肥-水泥联产的固体原料步运输,生成中需要大量的水,所以应建在沿海地区;
(2)①中冶炼钢铁的原料是Fe2O3,②中热电厂中向外提供的能量为电能,③利用沸腾炉中FeS2与氧气反应放出大量的热发电,④制硫酸时二氧化硫的循环利用,⑤硫酸工业中生成的硫酸,可用于制磷肥;
(3)接触室二氧化硫氧化生成三氧化硫;
普钙是磷酸二氢钙和硫酸钙,即硫酸与磷酸钙反应生成硫酸钙和磷酸二氢钙;
(4)根据S元素守恒可得关系式:FeS2 ~2H2SO4,将硫酸的产率转化为FeS2的利用率,结合关系式进行计算;
(5)浓缩盐水提取盐(NaCl)后,剩余的苦卤中含有丰富的Mg元素、溴元素等;
(6)根据工厂的废气、废渣的成分分析.
解答 解:(1)该产业链利用废热发电进行海水淡化、浓缩生成盐,而生成硫酸-磷肥-水泥联产的固体原料步运输,生成中需要大量的水,所以应建在沿海地区,故答案为:B;
(2)①中冶炼钢铁的原料是Fe2O3,②中热电厂中向外提供的能量为电能,③利用沸腾炉中FeS2与氧气反应放出大量的热发电,④制硫酸时二氧化硫的循环利用,⑤硫酸工业中生成的硫酸,可用于制磷肥,
故答案为:①Fe2O3;③热能;④SO2;
(3)接触室二氧化硫氧化生成三氧化硫,反应方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3,
普钙是磷酸二氢钙和硫酸钙,即硫酸与磷酸钙反应生成硫酸钙和磷酸二氢钙,反应方程式为:2Ca5(PO4)3F+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF;
故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3;2Ca5(PO4)3F+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF;
(4)FeS2制取硫酸过程中,设生成的98%的硫酸为x吨,由硫元素守恒,则:
FeS2 ~2H2SO4
120 2×98
1吨×36%×75% 98%x吨
则120:2×98=1吨×36%×75%:98%x吨,
解得x=0.45,
故答案为:0.45;
(5)海水浓缩盐水提取盐(NaCl)后,剩余的苦卤中含有丰富的Mg元素、溴元素等,可以制取Mg或溴,
故答案为:镁或溴;
(6)废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料,
故答案为:废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料.
点评 本题考查化学技术,涉及制工业炼铁、工业制备硫酸、水泥生产、磷肥工业、海水资源的综合利用、化学计算等,熟练掌握中学常见的化学工业,需要学生具备扎实的基础.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 随着不断放电,电解质溶液碱性不变 | |
| D. | 甲烷燃料电池也可以用稀硫酸做电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
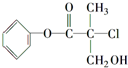 某有机物A是农药生产中的一种中间体,其结构简式如图所示.
某有机物A是农药生产中的一种中间体,其结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子N层上都有1个s电子,一个原子无d电子,另一个原子有d电子 | |
| B. | 两原子其核外全部都是s电子 | |
| C. | 最外层电子排布为2s22p5的原子和最外层电子排布为2s22p6的离子 | |
| D. | 原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2 s 的平均速率v(CO)=0.080mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=“0.11“mol•L-1,则反应的△H<0 | |
| C. | T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆 | |
| D. | T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com