
| 原子序数 | 电子层数 | 最外层电子数 | 达到稳定状态时的最外层电子数 |
| 1-2 | 1 | 2 | |
| 3-10 | 2 | 8 | |
| 11-18 | 3 | 8 | |
| 结论:随着原子序数的递增,元素原子的 | |||
| 原子序数 | 电子层数 | 最外层电子数 | 达到稳定状态时的最外层电子数 |
| 1-2 | 1 | 1至2 | 2 |
| 3-10 | 2 | 1至8 | 8 |
| 11-18 | 3 | 1至8 | 8 |
| 结论:随着原子序数的递增,元素原子的 最外层电子排布呈现周期性变化 | |||


科目:高中化学 来源: 题型:
| A、XYZ3 |
| B、XYZ4 |
| C、XYZ |
| D、X2YZ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、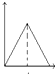 |
B、 |
C、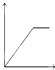 |
D、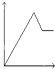 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸和氢氧化钡溶液反应 |
| B、硝酸和氢氧化铁反应 |
| C、盐酸和氢氧化钠溶液反应 |
| D、盐酸和氢氧化铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
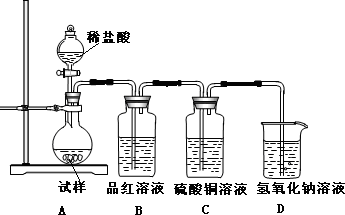
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气和水反应:Cl2+H2O=2H++Cl-+ClO- |
| B、NO2通入水中:3NO2+H2O=2H++2NO3-+NO↑ |
| C、氧化亚铁溶解于稀硝酸中:FeO+2H+﹦Fe2++H2O |
| D、氢氧化钠溶液中通入少量二氧化硫:SO2+OH-﹦HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com