
| V |
| Vm |
| n |
| V |
| 4.48L |
| 22.4L/mol |
| 0.2mol×1 |
| 2 |
| 0.1mol |
| 0.4L |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)═c(H+) |
| C、0.1 mol?L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| D、0.1 mol?L-1的硫化钠溶液中:c(OH-)=c(H+)>c(HS-)>c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑤ |
| C、①②④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
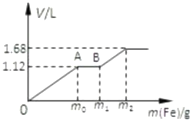 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
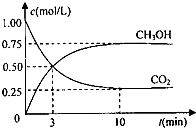 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
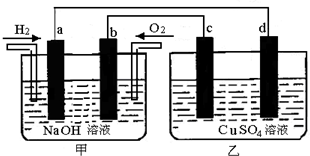
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com