
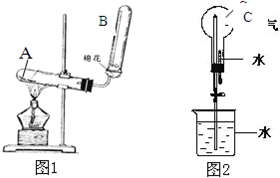
 如图是有关氨的制取和性质的实验装置.
如图是有关氨的制取和性质的实验装置.
| ||
| ||


科目:高中化学 来源: 题型:阅读理解
| 84(m1-m2) |
| 31m1 |
| 84(m1-m2) |
| 31m1 |
查看答案和解析>>
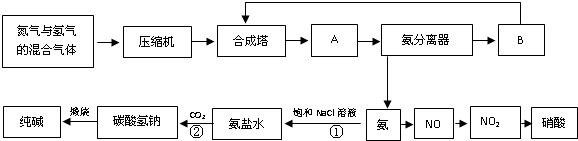
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||

| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

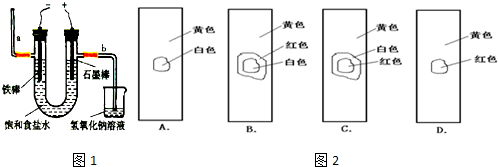
| ||
查看答案和解析>>
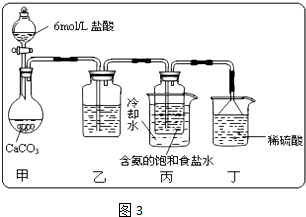
科目:高中化学 来源:高中化学习题 题型:022
制取氟氧氯化合物X,可采用特制的耐氟仪器.制备X的反应物是10%的![]() 溶液和
溶液和![]() ,使它们缓缓反应,产率不很高.化合物X中元素的质量分数是:Cl30%、O54%、F16%.且X的实验式量与相对分子质量相同.有关药品和物质的资料是:
,使它们缓缓反应,产率不很高.化合物X中元素的质量分数是:Cl30%、O54%、F16%.且X的实验式量与相对分子质量相同.有关药品和物质的资料是:
①无水KF为固体,易吸收![]() 、HF和
、HF和![]()
②X(化合物)的熔点-167.5℃,沸点-15.9℃,易分解,若接触有机物容易爆炸.
③![]() 沸点-188.14℃.HF沸点19.54℃,
沸点-188.14℃.HF沸点19.54℃,![]() 沸点-183℃,
沸点-183℃,![]() 沸点-33.35℃.
沸点-33.35℃.
实验装置如图:
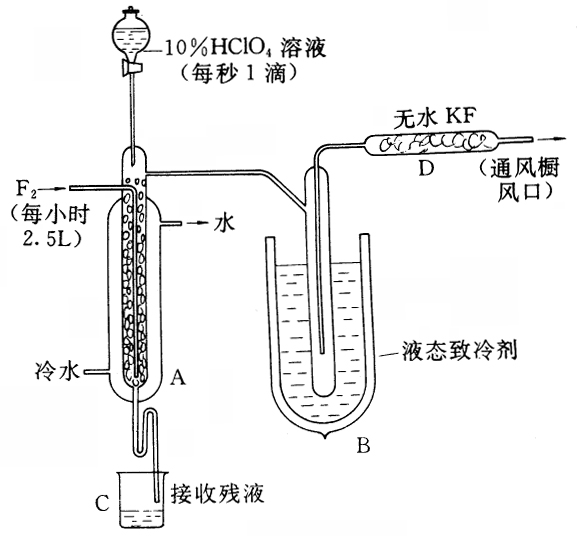
试回答
(1)X的化学式是________.
(2)![]() 与
与![]() 生成X的化学方程式________.
生成X的化学方程式________.
(3)D装置的作用是________.
(4)B中致冷液用液氧还是用液氨________,其理由是________.
(5)A中内管中填充许多耐氟的环状物,其作用是________.
(6)若把A内管的环状填充物换成耐氟的石墨环,则X的产率为0%,其主要理由是.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com