
【题目】CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.
(1)常温下中和100mL pH=3的CH3COOH溶液和1L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2 , 则V1V2 (填“>”、“=”或“<”),中和后所得溶液中离子浓度由大到小的顺序为 .
(2)用0.1000molL﹣1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线如图所示.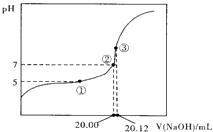
其中①点所示溶液中c(CH3COO﹣)=2c(CH3COOH),
③点所示溶液中存在:c(CH3COO﹣)+c(CH3COOH)═c(Na+).则CH3COOH的电离平衡常数Ka= , CH3COOH的实际浓度为 .
【答案】
(1)>;c(Na+)>C(CH3COO﹣)>c(OH﹣)>c(H+)
(2)2×10﹣5;0.1006mol/L
【解析】解:(1)相同温度下,酸的浓度越小其电离程度越大,所以pH=3醋酸的浓度大于pH=4醋酸浓度的10倍,100mLpH=3的CH3COOH溶液和1L pH=4的CH3COOH溶液,前者的物质的量大于后者,醋酸和碱反应消耗碱的物质的量与酸的物质的量成正比,所以消耗氢氧化钠体积V1>V2;醋酸钠是强碱弱酸盐,其溶液呈碱性,则c(OH﹣)>c(H+),再结合电荷守恒得c(Na+)>C(CH3COO﹣),醋酸根离子水解程度很小,所以溶液中离子浓度大小顺序是c(Na+)>C(CH3COO﹣)>c(OH﹣)>c(H+),所以答案是:>;c(Na+)>C(CH3COO﹣)>c(OH﹣)>c(H+);(2)根据③中物料守恒得醋酸浓度= ![]() =0.1006mol/L,A为缓冲溶液,pH=pKa﹣lgc(CH3COO﹣)/lgc(CH3COOH),5=pKa﹣lg2,10﹣5=
=0.1006mol/L,A为缓冲溶液,pH=pKa﹣lgc(CH3COO﹣)/lgc(CH3COOH),5=pKa﹣lg2,10﹣5= ![]() ,Ka=2×10﹣5 , 所以答案是:2×10﹣5;0.1006 mol/L.
,Ka=2×10﹣5 , 所以答案是:2×10﹣5;0.1006 mol/L.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO ![]() +2I﹣+2H+AsO
+2I﹣+2H+AsO ![]() +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( )
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( ) 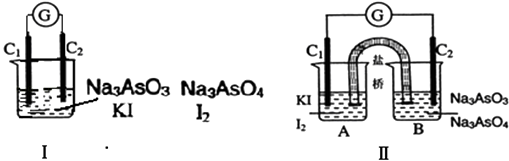
A.甲组操作时,微安表
B.指针发生偏转
C.甲组操作时,溶液颜色变深
D.乙组操作时,C2做正极
E.乙组操作时,C1上发生的电极反应为I2+2e﹣═2I﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验事故或废弃药品的处理方法正确的是( )
A. 当有大量毒气泄漏时,人应沿顺风方向疏散
B. 实验室里电线失火,首先要断开电源
C. 当少量浓硫酸沾在皮肤上,应立即用氢氧化钠溶液冲洗
D. 酒精失火用水浇灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法中,正确的是( )
A.合成氨过程是一个放热反应,所以升高温度,反应速率反而减小
B.等质量的镁粉和镁条与同体积、同浓度的稀硫酸作用,其反应速率相等
C.铝片与硫酸溶液反应可产生氢气,常温下用98%的浓硫酸可以加快生成氢气的速率
D.同温同体积时,浓度大的草酸溶液比浓度较小的使酸化高锰酸钾溶液褪色速度快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO ![]() )、c(HCO
)、c(HCO ![]() )都减少,其方法是( )
)都减少,其方法是( )
A.通入二氧化碳气体
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科学家预测,月球的土壤中吸附着数百万吨的3He,每百吨3He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4He的形式存在。下列说法中正确的是
A. 4He原子核内含有4个质子B. 3He和4He互为同位素
C. 3He原子核内含有3个中子D. 4He的最外层电子数为2,故 4He具有较强的金属性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com