
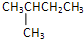 、新戊烷:
、新戊烷: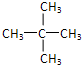 ,
,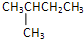 、
、 ;
; ,
, .
.


科目:高中化学 来源: 题型:
| A、阴极产物为H2 |
| B、阳极先析出Cl2,后析出O2 |
| C、电解液的pH不断增大,最终大于7 |
| D、整个电解的过程实质是电解水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.镍常见化合价为+2、+3,在水溶液中通常只以+2价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为
(1)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.镍常见化合价为+2、+3,在水溶液中通常只以+2价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该条件下反应的平衡常数为1.6×103 |
| B、通常情况下,该反应一定能自发进行 |
| C、题给条件下,O2的转化率是20% |
| D、当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com