

分析 (1)依据A装置中盛装KClO3的仪器图形和作用可知仪器为圆底烧瓶,C装置中是固体亚硫酸钠和浓硫酸反应生成二氧化硫气体;
(2)①验证还原性Fe2+>Cl-是利用装置中的反应,还原剂的还原性大于还原产物,可以先再A装置制备氯气通入B装置的氯化亚铁溶液中发生反应,溶液变化浅绿色为黄色溶液;
②验证还原性SO2>Fe2+是利用装置C制备二氧化硫气体,通入装置B中的氯化铁溶液中,溶液由黄色变化为浅绿色,氯化铁被二氧化硫还原生成氯化亚铁,氧化还原反应中还原剂还原性大于还原产物;
(3)检验硫酸根离子的实验方法是加入盐酸、氯化钡,观察是否有白色沉淀生成设计实验;
解答 解:(1)依据A装置中盛装KClO3的仪器图形和作用可知仪器为圆底烧瓶,C装置中是固体亚硫酸钠和浓硫酸反应生成二氧化硫气体反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,
故答案为:圆底烧瓶,Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)①验证还原性Fe2+>Cl-是利用装置中的反应,还原剂的还原性大于还原产物,可以先再A装置制备氯气通入B装置的氯化亚铁溶液中发生反应,溶液变化浅绿色为黄色溶液,操作是关闭K1 、K3、K4,打开K2、分液漏斗活塞a,发生反应Cl2+2Fe2+=2Fe3++2Cl-,依据现象和反应判断,还原剂Fe2+的还原性大于还原产物Cl-,故答案为:关闭K1 、K3、K4,打开K2、分液漏斗活塞a;
②验证还原性SO2>Fe2+是利用装置C制备二氧化硫气体,通入装置B中的氯化铁溶液中,溶液由黄色变化为浅绿色,氯化铁被二氧化硫还原生成氯化亚铁,2Fe3++SO2+H2O=2Fe2++2H++SO42-,氧化还原反应中还原剂SO2还原性大于还原产物Fe2+,操作为:关闭K1 、K2、K4,打开K3、分液漏斗活塞b,
故答案为:关闭K1 、K2、K4,打开K3、分液漏斗活塞b;
(3)检验硫酸根离子的实验方法是加入盐酸、氯化钡,观察是否有白色沉淀生成设计实验,实验结束时,检验实验后的B中溶液是否含有SO42-的操作方法为打开旋塞b,放出少量溶液于D中,加入盐酸无现象,加入氯化钡溶液生成白色沉淀是硫酸钡沉淀,证明原溶液中含硫酸根离子,
故答案为:加入盐酸无现象,加入氯化钡溶液生成白色沉淀,证明含硫酸根离子;
点评 本题考查了物质制备、物质检验、氧化还原反应中还原性强弱比较的实验设计步骤和反应原理,注意装置中活塞开关的作用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
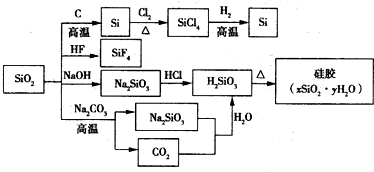
| A. | SiO2属于两性氧化物 | |
| B. | 盛放Na2CO3溶液的试剂瓶不能用玻璃塞 | |
| C. | 硅胶吸水后可重复再生 | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- | |
| B. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、SO42-、SCN- | |
| D. | 使紫色石蕊试液变红的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
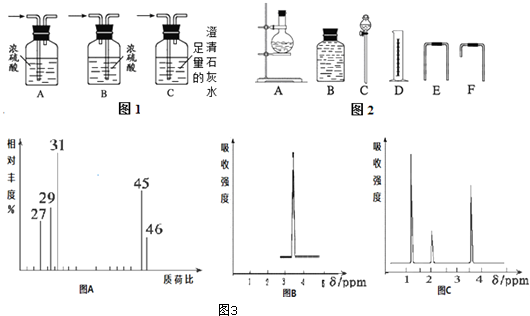
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
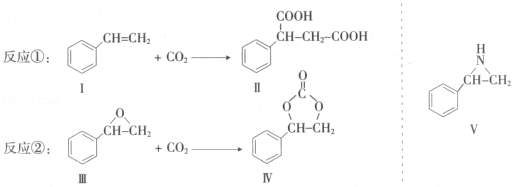
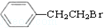 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为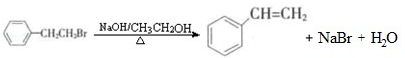 (注明反应条件).
(注明反应条件).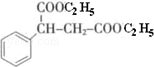 .
.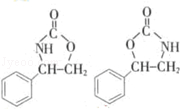 .
.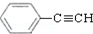 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有AB(双选,填字母).
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有AB(双选,填字母).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在氯气中燃烧产生苍白色火焰 | |
| B. | 铁丝在氯气中燃烧生成FeCl2 | |
| C. | 氯气的水溶液用于漂白,是利用氯气的强氧化性 | |
| D. | 当有大量氯气逸到空气中时,可用浸有NaOH溶液的毛巾捂住鼻子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com