
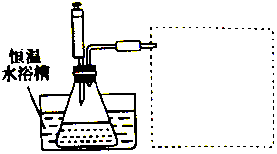
 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:| 实验序号 | 参加反应的物质 | 收集amL(在标准状况下)O2所需时间/s | ||||
| 酸性Fe2(SO4)3溶液 | H2O2溶液 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 4 | 0.1 | 3 | 4 | 3 | t1 |
| ② | 4 | 0.1 | 2 | 4 | V1 | 5 |
| ③ | V2 | 0.1 | V3 | 4 | 2 | t3 |
分析 (1)控制溶液总体积相等,改变反应物以及催化剂用量即可探究浓度、催化剂用量对H2O2分解速率的影响;改变催化剂的用量,双氧水的用量相同,根据反应时间的快慢得出结论;
(2)根据2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,计算双氧水在0~5s浓度的变化,再根据v=$\frac{△c}{△t}$计算;
(3)利用排水法收集氧气,体积量取用量筒;
(4)催化剂参与反应过程并在最后生成,故第二个阶段为另一部分过氧化氢将亚铁离子氧化成三价铁离子,据此写出离子方程式.
解答 解:(1)探究浓度、催化剂用量对H2O2分解速率的影响,应控制溶液总体积相等,改变反应物以及催化剂用量即可,实验①的总体积是4mL+3mL+
3mL=10mL,则实验②中V1=10mL-4mL-2mL=4mL;若V2=5,则V3=10mL-5mL-2mL=3mL,实验①、③对比,双氧水的用量(浓度)相同,实验③增大的了催化剂的用量(浓度),t3<t1,说明实验③反应更快,则由实验①、③可以得出的结论是增大催化剂浓度,可加快反应速率,
故答案为:4;增大催化剂浓度,可加快反应速率;
(2)0~5s在标况下收集到氧气amL,氧气的物质的量为:n(O2)=$\frac{a×1{0}^{-3}L}{22.4L/mol}$,根据2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,则消耗的双氧水的物质的量为:2n(O2)=2×$\frac{a×1{0}^{-3}L}{22.4L/mol}$,双氧水在0~5s浓度的变化为:△c=$\frac{△n}{V}$=$\frac{2×\frac{a×1{0}^{-3}L}{22.4L/mol}}{10×1{0}^{-3}L}$=$\frac{a}{112}$mol/L,v=$\frac{△c}{△t}$=$\frac{\frac{a}{112}mol/L}{5s}$=$\frac{a}{560}mol•{L}^{-1}•{s}^{-1}$,
故答案为:$\frac{a}{560}mol•{L}^{-1}•{s}^{-1}$;
(3)氧气难溶于水,利用排水法收集氧气,水的体积等于氧气的体积,可用量筒量取,装置图为: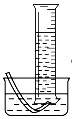 ,
,
故答案为: ;
;
(4)催化剂参与反应过程并在最后生成,故第二个阶段为另一部分过氧化氢将亚铁离子氧化成三价铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O.
点评 本题考查影响化学反应速率的因素,明确浓度、催化剂等对反应速率的影响即可解答,注意控制变量法在实验中的应用,注重基础知识的考查,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe(OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加入H2O2 后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③ | B. | ③>②>① | C. | ②>③>① | D. | ③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(H+)=10-13mol/L的溶液中:NH4+、Al3+、Fe3+、NO3- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-3mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 溶有NaHSO4的溶液中:K+、SO42-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4、NaOH--腐蚀品 | B. | 酒精--易燃气体 | ||
| C. | KMnO4--氧化剂 | D. | 甲烷--易燃气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
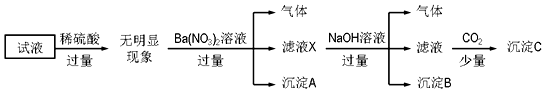
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| C. | 沉淀C为Al(OH)3 | |
| D. | 无法确定原试液中是否含有K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
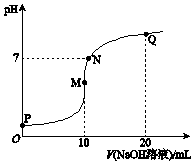 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )| A. | P点pH较低的主要原因是NH4+水解 | |
| B. | P、M、N、Q四点中,水的电离程度较大的是N点 | |
| C. | M点 c(Na+)>c(NH4+); N点 c(NH4+)+c(Na+)═2c(SO42-) | |
| D. | Q点 c(NH4+)+c(NH3•H2O)═c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
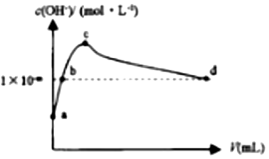 常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-mmol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com