
【题目】现有 0.1L 无色溶液,其含有的阳离子可能是 K+、Cu2+、Ca2+,含有的阴离子可能 Cl-、CO32-、SO42-现做以下实验:
①取 50mL 溶液置于大烧杯中,向溶液中加入过量的 BaCl2 溶液振荡,有白色沉淀生成;过滤,洗涤, 干燥,后称得 4.30g 固体
②将所得白色固体配成悬浊液后加入过量稀硝酸,白色沉淀部分消失,并有气泡产生;将剩余固体过 滤洗涤干燥后称量得到 2.33g
③取少量①实验后上层清液滴入 AgNO3 溶液,有白色沉淀生成。
(1)根据上述实验现象,判断原溶液中肯定不含有_____(填离子符号),一定含有__________________(填离子符号),可能含有_____(填离子符号),请设计方案证明原溶液中可能含 有的离子:_________。
(2)写出上述过程中一定发生反应的离子方程式:_________。
(3)若经证明没有 Cl—则该溶液中的 K+的物质的量浓度是:________________________。
【答案】Cu2+、Ca2+ K+、CO32-、SO42- Cl- 取一定量的原溶液于烧杯中,加入过量Ba(NO3)2使碳酸根、硫酸根完全沉淀后,取上层清液,加入AgNO3溶液,若有白色沉淀则有Cl- Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓、BaCO3+2H+=Ba2++CO2+H2O、Ag+Cl-=AgCl↓ 0.8mol
【解析】
溶液无色,一定不存在铜离子;①取50mL的溶液在大烧杯中加入中,向溶液中加入过量的BaCl2溶液振荡,有白色沉淀生成;过滤,干燥,烘干后得4.30g固体,说明碳酸根和硫酸根至少含有一种;②将所得白色固体配成悬浊液后加入过量稀硝酸,白色沉淀部分消失,并有气泡产生;将剩余固体过滤干燥后称量得到2.33g,说明白色沉淀是碳酸钡和硫酸钡的混合物,则一定存在碳酸根和硫酸根,因此一定不存在钙离子,根据溶液显电中性可知一定存在钾离子;③取少量①实验后上层清液滴入AgNO3溶液,有白色沉淀生成,白色沉淀是氯化银,但引入了氯化钡,所以不能确定是否含有氯离子。
(1)根据上述实验现象,判断原溶液中肯定不含有Cu2+、 Ca2+,一定含有K+、CO32-、SO42-,可能含有氯离子,证明含有氯离子的实验方案是:取一定量的原溶液于烧杯中,加入过量的Ba(NO3)2溶液使CO32-、SO42-完全沉淀后取上层清液于试管中加入AgNO3溶液,若有白色沉淀则有Cl﹣,若无白色沉淀则无Cl﹣;
(2)根据以上分析可知一定发生的离子方程式为:CO32-+Ba2+=BaCO3↓、SO42-+Ba2+=BaSO4↓、BaCO3 +2H+=Ba2++CO2↑+H2O、Ag++Cl-=AgCl↓;
(3)硫酸钡的物质的量是![]() =0.01mol,碳酸钡质量=4.30g-2.33g=1.97g,物质的量是0.01mol,根据电荷守恒可知若经证明没有Cl﹣则该溶液中的K+的物质的量是0.004mol,浓度是
=0.01mol,碳酸钡质量=4.30g-2.33g=1.97g,物质的量是0.01mol,根据电荷守恒可知若经证明没有Cl﹣则该溶液中的K+的物质的量是0.004mol,浓度是![]() =0.8mol/L。
=0.8mol/L。


科目:高中化学 来源: 题型:
【题目】以A为原料可制备C(丹皮酚)和D(树脂),其合成路线如下:

(1)A在空气中会缓慢变成粉红色,其原因是_____________________________________。
(2)A→B的反应类型为______________________;A生成D的反应中,试剂X(烃的含氧衍生物)为____________________(写结构简式)。
(3)只含有两个取代基的芳香化合物E是C的同分异构体,E既能与FeCl3溶液发生显色反应又能发生银镜反应和水解反应,则E共有________种(不考虑立体结构),其中核磁共振氢谱为六组峰且峰面积比为1:1:2:2:2:2 的结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家威廉·诺尔斯、柏利·沙普利斯和日本化学家野依良治因通过使用快速和可控的重要化学反应来合成某些手性分子的方法而获得2001年的诺贝尔化学奖。所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物: 有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A. 与乙酸发生酯化反应 B. 与NaOH水溶液共热
C. 在催化剂存在下与氢气作用 D. 与银氨溶液作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素,用化学用语回答以下问题。
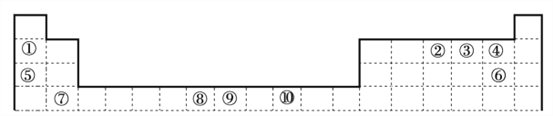
(1)其中属于过渡元素的是_____________,比较②的氢化物与同族第3、4周期元素所形成的氢化物沸点高低并说明理由_____________
(2)②与③中第一电离能较小的元素是_____________;①和④形成的物质与⑤和⑥形成的物质晶体中熔点较高的是_____________。
(3)①形成的有机试剂在有机合成中有重要应用,但极易与O2、CO2等反应。下列说法不正确的是_____________(填字母序号)
a.CO2中键σ与π键的数目之比为1:1
b.游离态和化合态①元素均可由特征发射光谱检出
c.叔丁基锂([(CH3)3C]Li)中碳原子的杂化轨道类型为sp3和sp2
(4)如图一是上述元素形成的物质晶胞结构示意图,其化学式为_____________,其中Fen+的基态电子排布式为_____________,PO43-的空间构型为_____________
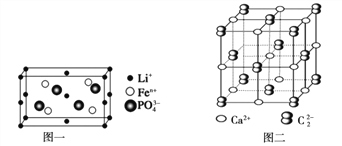
(5)金属①的晶体为体心立方晶胞,其配位数为_____________;若其晶胞边长为a pm,则锂晶体中原子的空间占有率是_____________
(6)上述元素形成的CaC2晶体的晶胞结构与NaCl晶体的相似(如图二所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长(粒子间距增加)。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是( )
A.节约用水用电B.利用风力发电
C.增加植被面积D.燃烧煤炭供热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林的化学成分是乙酰水杨酸,在胃内分解成水杨酸。若服用阿司匹林过量时可出现头痛、眩晕、恶心、呕吐、耳鸣,甚至精神错乱等副作用,称之为水杨酸反应。若出现水杨酸反应,应该采取的措施是
A. 饮用大量清水 B. 洗胃 C. 减少用药量 D. 停药,静脉滴注NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将牛奶和姜汁混合,待牛奶凝固便成为一种富有广东特色的甜品——姜撞奶。为了掌握牛奶凝固所需的条件,某同学在不同温度的等量牛奶中混人一些新鲜姜汁,观察混合物15min,看其是否会凝固,结果如下表。请回答下列问题:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
结果 | 15min后仍未有凝固迹象 | 14min内完全凝固 | 1min内完全凝固 | 1min内完全凝固 | 15min后仍未有凝固迹象 |
(注:用曾煮沸的姜汁重复这项实验,牛奶在任何温度下均不能凝固)
(1)实验证明新鲜姜汁中含有一种酶,其作用是 。
(2)20℃和100℃时,15min后仍未有凝固迹象,说明酶的活性较低,其原因分别是 和 。
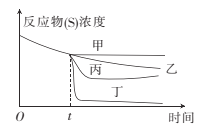
(3)若60℃时牛奶在有姜汁和没有姜汁的情况下都可以凝固,当反应进行到t时,向其中加人姜汁。下图中能正确表示加姜汁后牛奶凝固随时间变化趋势的曲线是 。
(4)为提高实验的准确度,实验中“不同温度的等量牛奶中混入一些新鲜姜汁”操作中应注意的是 。
(5)有同学说,该实验不能得出姜汁使牛奶凝固的最适温度,请提出解决方案: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑料废弃物又称“白色污染”,它的危害有
① 难以分解,破坏土壤结构,影响植物生长 ② 污染海洋 ③ 危及海洋生物的生存 ④ 破坏环境卫生,污染地下水
A. ①②③ B. ①③④ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,将a g NH3完全溶于水,得到V mL溶液,设该溶液的密度为ρ g·cm-3,质量分数为ω,其中含N的物质的量为b mol。下列叙述中不正确的是
A. 溶质的质量分数ω=![]() ×100%
×100%
B. 溶质的物质的量浓度c= 1000a/17Vmol·L-1
C. 溶液中c(OH-)= 1000b/Vmol·L-1+c(H+)
D. 上述溶液中再加入V mL水后,所得溶液中溶质的质量分数小于0.5ω
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com