
| A. | 漂白粉中加入浓盐酸:ClO-+Cl-+2H+═Cl2↑+H2O | |
| B. | 氯化铁溶液洗涤银镜:Fe3++Ag═Fe2++Ag+ | |
| C. | 0.1 mol•L-1NH4HSO4溶液和0.1 mol•L-1NaOH等体积混合:NH4++H++2OH-═NH3•H2O+H2O | |
| D. | 0.1 mol•L-1的NaAlO2溶液和0.15 mol•L-1的H2SO4溶液等体积混合:AlO2-+4H+═Al3++2H2O |
分析 A.次氯酸根和氯离子在酸性条件下发生反应生成氯气;
B.铁离子与银单质不发生反应;
C.硫酸氢铵与氢氧化钠的物质的量相等,氢氧根离子不足,硫酸氢铵电离出的氢离子优先反应,铵根离子不反应;
D.计算出偏铝酸钠和硫酸的物质的量,然后根据过量情况判断反应产物.
解答 解:A.漂白粉中加入浓盐酸,二者反应生成氯气,反应的离子方程式为:ClO-+Cl-+2H+═Cl2↑+H2O,故A正确;
B.由于铁离子的氧化性小于银离子,铁离子与银单质不发生反应,故B错误;
C.0.1 mol•L-1NH4HSO4溶液和0.1 mol•L-1NaOH等体积混合,氢氧化钠不足,只有氢离子参与反应,正确的离子方程式为:H++OH-═H2O,故C错误;
D.偏铝酸根离子与氢离子的物质的量之比为1:3,设偏铝酸根离子为mol,氢离子为3mol,1molAlO2-与1molH+反应生成1molAl(OH)3,剩余的2mol氢离子溶解氢氧化铝的物质的量为:$\frac{2mol}{3}$=$\frac{2}{3}$mol,则反应生成氢氧化铝和铝离子的物质的量制备为1:2,正确的离子方程式为:3AlO2-+9H+═2Al3++Al(OH)3↓+3H2O,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;D为易错点,根据反应物的量正确判断反应产物为解答关键.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 以B表示的平均反应速率为v(B)=0.0625mol•L-1•s-1 | |
| B. | 4min时,A的物质的量为0.75mol | |
| C. | 该反应方程式中,x=2 | |
| D. | 4min时,B的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
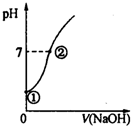 常温下,向饱和氯水中逐滴滴入0.10mol•L-1的氢氧化钠溶液,溶液的pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.10mol•L-1的氢氧化钠溶液,溶液的pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HClO的电离平衡 | |
| B. | 水的电离程度:①>② | |
| C. | I-在②点所示溶液中能稳定存在 | |
| D. | ②点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
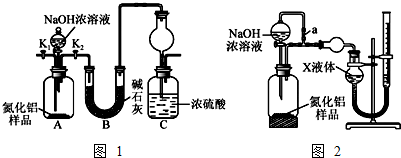
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向品红溶液中分别通入SO2和Cl2,品红均褪色 | |
| B. | 向裂化汽油和苯乙烯中分别加入溴水,溴水均褪色 | |
| C. | 分别加热盛有氯化铵和单质碘的试管,内壁或管口均有固体凝结 | |
| D. | 分别向鸡蛋白溶液中加入饱和硫酸铵溶液和甲醛溶液,均有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
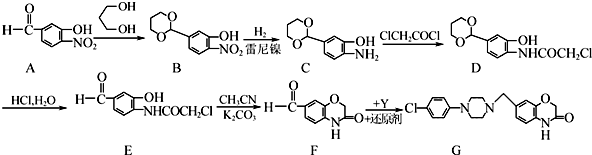
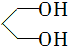 的名称为1,3丙二醇;设计步骤A→B的目的是保护醛基,防止被还原.
的名称为1,3丙二醇;设计步骤A→B的目的是保护醛基,防止被还原. .
.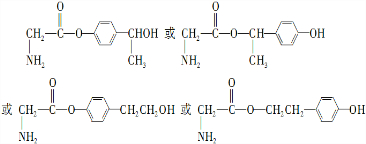 .
.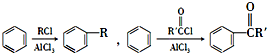
 易氧化,酰胺基(
易氧化,酰胺基(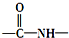 )难以被H2还原.
)难以被H2还原.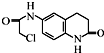 )是合成一种新型口服强心药的中间体,请写出以
)是合成一种新型口服强心药的中间体,请写出以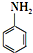 、ClCH2CH2COCl、ClCH2COCl为原料制备Z的合成路线流程图(无机试剂可任选).
、ClCH2CH2COCl、ClCH2COCl为原料制备Z的合成路线流程图(无机试剂可任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
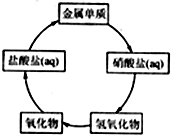 在一定条件下,五种含有同种金属元素的单质或其化合物,能按有图箭头方向实现一步转化(不含电解),该金属元素可能是 ( )
在一定条件下,五种含有同种金属元素的单质或其化合物,能按有图箭头方向实现一步转化(不含电解),该金属元素可能是 ( )| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
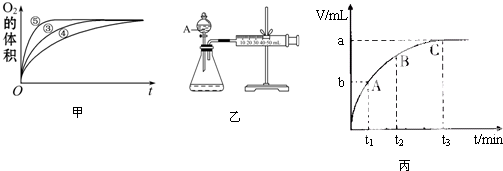
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com