
【题目】NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 60gSiO2晶体中含有4NA条硅氧键
B. 1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有的OH-离子数为0.1 NA
D. K35ClO3与浓H37Cl反应制得7.2gCl2,则生成的Cl2分子数为0.1 NA
【答案】A
【解析】A. 60gSiO2晶体的物质的量为![]() =1mol,1 mol SiO2中含有4 mol Si—O键,含有4NA条硅氧键,故A正确;B. 氯气与水的反应是可逆反应,1molCl2通入水中,氯水中还含有氯气分子,因此HClO、Cl-、ClO-粒子数之和小于2NA,故B错误;C. 未告知溶液的体积,无法计算25℃,pH=13的Ba(OH)2溶液中含有的OH-离子数,故C错误;D. 根据化合价升降守恒,K35ClO3与浓H37Cl反应制得的Cl2中含有
=1mol,1 mol SiO2中含有4 mol Si—O键,含有4NA条硅氧键,故A正确;B. 氯气与水的反应是可逆反应,1molCl2通入水中,氯水中还含有氯气分子,因此HClO、Cl-、ClO-粒子数之和小于2NA,故B错误;C. 未告知溶液的体积,无法计算25℃,pH=13的Ba(OH)2溶液中含有的OH-离子数,故C错误;D. 根据化合价升降守恒,K35ClO3与浓H37Cl反应制得的Cl2中含有![]() 的35Cl和
的35Cl和![]() 的37Cl,该氯气的相对分子质量为(
的37Cl,该氯气的相对分子质量为(![]() ×35+
×35+![]() ×37)×2=73.3,7.2gCl2的物质的量小于0.1mol,则生成的Cl2分子数少于0.1 NA,故D错误;故选A。
×37)×2=73.3,7.2gCl2的物质的量小于0.1mol,则生成的Cl2分子数少于0.1 NA,故D错误;故选A。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaOH(s)
B.CH3COONa(s)
C.NH4Cl(s)
D.Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系的压强不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、M、N 为六种短周期元素,其原子半径和最外层电子数之间的关系如下图一所示。

(1) 比较R、N、M三种元素简单离子的半径由小到大的顺序___<___<___ (填离子符号)。
(2) 化合物RYZ 的电子式为______,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为______。
(3) 图二转化关系中的A、B、C、D四种化合物均由上述六种元素中的若干种构成,其中B为气体。

①若C的溶液呈酸性,C溶液中有五种离子,其离子浓度由大到小的顺序是___________。
②若C 的溶液呈碱性,则C 可能是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( ) 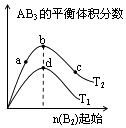
A.图中T2一定大于T1
B.图中b点速率一定大于d点速率
C.达到平衡时,A2的转化率大小为:c>b>a
D.加入催化剂可以使状态d变为状态b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于“地球上的生命是在碳元素的基础上建立起来的”原因的叙述,错误的是( )
A. 碳元素在生物体内含量最多
B. 碳原子含有4个价电子
C. 碳原子之间能以共价键结合
D. 许多含碳有机物能连接成链或环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种含氧酸,在工业上有广泛的应用,其钠盐同样也是重要的化工产品。
Ⅰ.硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置模拟生成过程:

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)烧瓶A中发生反应的离子方程式为_________________________________。装置D的作用是__________________________。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择_____________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有______
a.烧杯 b.燕发皿 c.试管 d.锥形瓶
(4)为了保证Na2S2O3的产量,实验中通入SO2不能过量,原因是_____________________。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。(Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3-电离程度大于水解程度,可采用的实验方法有________________。
a.测定溶液的pH b.加入Ba(OH)2溶液 c. .加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定菜葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI):
![]()
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为______g/L
②在上述实验过程中,HI可能会被空气氧化,反应的化学方程式为_____________________________。若有部分HI被空气氧化,会导致测得的结果_______(填“偏高”“ 偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
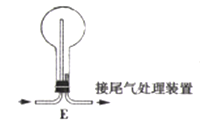
【题目】氨气能与金属氧化物(MxOy) 反应生成M、N2和H2O,根据测定出H2O的量可推出金属M的相对原子质量,某研究小组同学用下列装置进行相关实验探究。请回答下列问题:

(1)按气流方向,正确的装置接口顺序为c![]() _________ (填序号,装置可重复使用)。
_________ (填序号,装置可重复使用)。
(2)装置D中盛放的药品名称为______,装置C的作用是_______.
(3)若实验中准确称取金属氧化物的质量为zg,完全反应后,测得D中生成水的质量为wg.则M的相对原子质量为_____(用含x、y z、w的式子表示)。
(4) 某同学仔细分析上述装置后认为仍存在缺陷。你认为该如何改进:_________.
(5) 某同学用装置A、B、D以及装置E进行NH;的催化氧化实验研究,其中装置D盛放的药品为Na2O2。
①装置B中盛放的药品为________.
②装置A中发生反应的化学方程式为_____________
③验证有NO生成的反应现象为_________,E中发生反应的化学方程式为____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com