
 .
. 等.
等.分析 (1)烃含有C、H两种元素,某烃A0.2mol在氧气的充分燃烧后生成化合物B、C各1.2mol,即生成CO2、H2O各1.2mol,则1mol烃中含有6molC,12molH原子,A分子式为C6H12;
(2)根据燃烧方程式计算A的物质的量、消耗氧气的物质的量,再根据m=nM计算烃A的质量,根据V=nVm计算消耗氧气的体积;
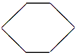
(3)若烃A不能使溴水褪色,说明有机物中不含C=C官能团,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷;
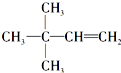
(4)若烃A能使溴水褪色,在催化剂作用下与H2加成生成,其加成产物经测定,分子中含有4个甲基,
生成的烷烃结构式为 或
或 ,说明分子中含有1个C=C键,相邻两个碳原子都含有H原子为C=C双键位置,据此确定A的结构简式;
,说明分子中含有1个C=C键,相邻两个碳原子都含有H原子为C=C双键位置,据此确定A的结构简式;
(5)比烃A少2个碳原子的同系物分子式为C4H8.
解答 解:(1)烃含有C、H两种元素,某烃A0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,则1mol烃中含有6molC,12molH原子,分子式为C6H12,
故答案为:C6H12;
(2)C6H12完全燃烧,生成3molCO2和H2O,则:
C6H12+9O2$\frac{\underline{\;点燃\;}}{\;}$6CO2+6H2O
1mol 9mol 6mol 6mol
0.5mol 4.5mol 3mol 3mol
当生成3molCO2和H2O时,需要0.5molC6H12,m(C6H12)=0.5mol×84g/mol=42g,
需要氧气的体积为V(O2)=4.5mol×22.4L/mol=100.8L,
故答案为:42;100.8;
(3)若烃A不能使溴水褪色,说明有机物中不含C=C官能团,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷,结构简式为 ,故答案为:
,故答案为: ;
;
(4)若烃A能使溴水褪色,在催化剂作用下与H2加成生成,其加成产物经测定,分子中含有4个甲基,
生成的烷烃结构式为 或
或 ,说明分子中含有1个C=C键,相邻两个碳原子都含有H原子为C=C双键位置,故A的结构简式为:
,说明分子中含有1个C=C键,相邻两个碳原子都含有H原子为C=C双键位置,故A的结构简式为: 、
、 、
、 ,
,
故答案为: 等;
等;
(5)比烃A少2个碳原子的同系物分子式为C4H8,结构简式为CH2=CHCH2CH3,CH3CH=CHCH3(顺反异构2种),CH2=C(CH3)2,所以有4种同分异构体,其中能和H2发生加成反应生成2-甲基丙烷的烯烃为CH2=C(CH3)2,名称是2-甲基丙烯,
故答案为:4;2-甲基丙烯.
点评 本题考查有机物分子式确定、限制条件同分异构体书写等,侧重考查学生分析推理能力,会根据烷烃结构确定烯烃,(5)中注意烯烃的顺反异构现象.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
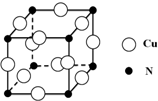 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.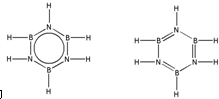 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
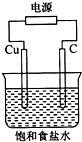
| A. | 石墨电极与直流电源负极相连 | |
| B. | 铜电极的反应式为:2H++2e-═H2↑ | |
| C. | 氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移 | |
| D. | 用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
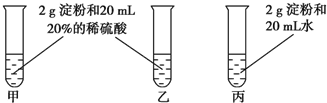 为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热.待试管甲中的溶液冷却后再进行后续实验.
为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热.待试管甲中的溶液冷却后再进行后续实验.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4→CuSO4 | B. | MnO4-→Mn2+ | C. | Fe→FeCl3 | D. | NaNO3→N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com