
| A、SO2 |
| B、CuS |
| C、FeCl3 |
| D、Fe3O4 |


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
 已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时体积相同.发生反应:2NO2(g)?N2O4 (g)△H<0.一段时间后相继达到平衡状态.下列说法中正确的是( )
已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时体积相同.发生反应:2NO2(g)?N2O4 (g)△H<0.一段时间后相继达到平衡状态.下列说法中正确的是( )| A、平衡时NO2体积分数:甲<乙 |
| B、达到平衡所需时间,甲与乙相等 |
| C、该反应的平衡常数表达式K=c(N2O4)/c(NO2) |
| D、若两容器内气体的压强保持不变,均说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 |
| B、当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零 |
| C、平衡状态时,各物质的浓度保持相等 |
| D、化学反应的限度不可以通过改变条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NA=
| ||||
B、NA=
| ||||
C、
| ||||
| D、以上均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、这四种元素处于同一周期 |
| B、离子半径:A2+>B+>C->D2- |
| C、A与D的质子数相差4 |
| D、还原性:C-<D2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1 | |||
B、500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| C、氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |||
| D、氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在CaF2晶体中,Ca2+、F-的配位数均为8 |
| B、C60晶体中,微粒之间通过共价键结合形成晶体,键角为120° |
| C、在CsCl晶体中,每个Cs+周围紧邻6个Cl- |
| D、金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 |
| B、除去氧气中少量氮气:使气体通过炽热的铜粉 |
| C、除去石英中少量碳酸钙:用稀盐酸溶解后过滤 |
| D、除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
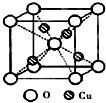 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| C-O | C=O | C≡O | |
| CO | 357.7 | 798.9 | 1071.9 |
| N-N | N=N | N≡N | |
| N2 | 154.8 | 418.4 | 941.7 |
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com