
| 【系列一】实验 | 溶液X | 实验现象 | |
| 实验Ⅰ | 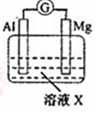 | 1mol/L稀硝酸 | 观察到电流计指针向左偏转. |
| 实验Ⅱ | 6mol/L稀硝酸 | 观察到电流计指针向左偏转,铝片表面产生无色气体,在液面上方变为红棕色 | |
| 实验Ⅲ | 6mol/LNaOH溶液 | 观察到(现象写在答题处). | |
| 实验Ⅳ | 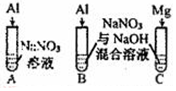 | A、C中均无明显现象,B中有无色气体生成. | |
分析 (1)原电池中铝做负极,铝做正极,硝酸在正极还原成铵根离子;
(2)电子从负极流向正极,故电子3Mg电极经导线到Al极;
(3)负极发生的反应为Al-3e-+4OH-=AlO2-+2H2O,正极发生的反应为2H2O+2e-=H2↑+2OH-,故观察到的现象是电流计指针向右偏转,Mg电极上有无色气体产生;负极发生氧化反应,电极方程式为Al-3e-+4OH-=AlO2-+2H2O;
(4)碱性条件下铝能与碱反应生成氢气,氢气有还原性,可以将硝酸根还原生成氨气,据此极性分析;
(5)NO3-氧化SO2,则硝酸根被还原成一氧化氮,一氧化氮可以再被氧化成二氧化氮,使得液面上方略显浅棕色,SO2被氧化成SO42-,SO42-与Ba(NO3)2产生白色沉淀;
(6)乙同学要证明了自己的推测正确,应使用钡盐且阴离子不能氧化二氧化硫,这样才可以做对比;
(7)Ba(NO3)2溶液与SO2反应生成硫酸钡和一氧化氮,反应的离子方程式为3Ba(NO3)2+3SO2+2H2O=3BaSO4↓+2NO+4HNO3①,2SO2+O2=2SO3②,氧化等量的SO2,由①②得6Ba(NO3)2~6SO2~3O2,据此求消耗二者物质的量之比.
解答 解:(1)硝酸在正极还原成铵根离子,故生成NH4+的电极反应式是NO3-+8e-+10 H+=NH4++3H2O,
故答案为:NO3-+8e-+10 H+=NH4++3H2O;
(2)电子从负极流向正极,故电子Mg电极经导线到Al极,
故答案为:电子Mg电极经导线到Al极;
(3)负极发生的反应为Al-3e-+4OH-=AlO2-+2H2O,正极发生的反应为2H2O+2e-=H2↑+2OH-,故观察到的现象是电流计指针向右偏转,Mg电极上有无色气体产生;负极发生氧化反应,电极方程式为Al-3e-+4OH-=AlO2-+2H2O,
故答案为:电流计指针向右偏转,Mg电极上有无色气体产生;Al-3e-+4OH-=AlO2-+2H2O;
(4)碱性条件下铝能与碱反应生成氢气,氢气有还原性,可以将硝酸根还原生成氨气,故实验IV,推测B中气体成分可能为NH3、H2,
故答案为:NH3、H2;
(5)NO3-氧化SO2,则硝酸根被还原成一氧化氮,一氧化氮可以再被氧化成二氧化氮,使得液面上方略显浅棕色,SO2被氧化成SO42-,SO42-与Ba(NO3)2产生白色沉淀,
故答案为:溶液中有沉淀产生;接近瓶口处显浅棕色;
(6)乙同学要证明了自己的推测正确,应使用钡盐且阴离子不能氧化二氧化硫,这样才可以做对比,所以所用试剂为0.1mol/LBaCl2溶液,可以看到有白色沉淀出现,
故答案为:BaCl2;试管内有白色沉淀产生;
(7)Ba(NO3)2溶液与SO2反应生成硫酸钡和一氧化氮,反应的离子方程式为3Ba(NO3)2+3SO2+2H2O=3BaSO4↓+2NO+4HNO3①,2SO2+O2=2SO3②,氧化等量的SO2,由①②得6Ba(NO3)2~6SO2~3O2,故消耗二者物质的量之比为6:3=2:1,
故答案为:2:1.
点评 本题考查原电池工作原理,题目难度中等,明确不同浓度的硝酸与铝的反应是解答本题的关键,明确原电池的正负极与电解质溶液、铝的性质、另一电极材料的活动性强弱有关.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
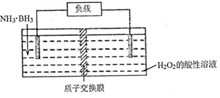 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )| A. | 负极附近溶液的PH增大 | |
| B. | 正极的反应式为:H2O2+2H++2e-=2H2O | |
| C. | 电池工作时,BO2-通过质子交换膜向正极移动 | |
| D. | 消耗3.lg氨硼烷,理论上转移0.2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
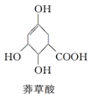
| A. | 分子中含有2种官能团 | |
| B. | 1mol莽草酸与Na反应最多生成4mol氢气 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为10 的氧原子:10O | |
| B. | 过氧化氢的电子式:H-O-O-H | |
| C. | CS2中各原子最外层都满足8 电子结构 | |
| D. | CH2Cl2是四面体构型的含非极性健的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向0.1mol/LNH4HSO4溶液中滴加NaOH溶液至中性C(Na+)>c(SO42-)>c(NH4+)>c(OH-)=C(H+) | |
| B. | 向饱和NaClO溶液中滴加少量饱和FeSO4溶液,反应的离子方程式为2Fe2++ClO-+5H2O═2Fe(OH)3↓+Cl-+4H+ | |
| C. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH2COO-)-c(CH2COOH) | |
| D. | 常温下cmol/L、电离常数为Ka的酸HA溶液中,由水电离的浓度为c(H+)水=$\frac{1{0}^{-14}}{\sqrt{Ka•c}}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②>④>③>① | B. | ①>②>④>③ | C. | ①>②>③>④ | D. | ③>②>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为8的氮原子:${\;}_{8}^{15}$N | B. | 乙醇的实验式:C2H6O | ||
| C. | 氯化镁的电子式: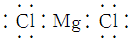 | D. | 硫原子的结构示意图: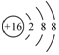 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | lmol N2、3molH2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | C甲 | C乙 | C丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | v甲 | V乙 | V丙 |
| A. | V甲>V丙 | B. | C乙>C甲 | C. | K乙>K丙 | D. | V甲=V丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com