
金属及其化合物在国民经济发展中起着重要作用。
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:

该反应的氧化剂是_________,当生成19.2gCu时,反应中转移的电子为_____mol。铜在潮湿的空气中能发生吸氧腐蚀而生成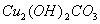 (碱式碳酸同)。该过程负极的电极反应式_______________。
(碱式碳酸同)。该过程负极的电极反应式_______________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(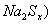 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体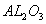 陶瓷(可传导
陶瓷(可传导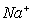 )为电解质,其原理如图所示:
)为电解质,其原理如图所示: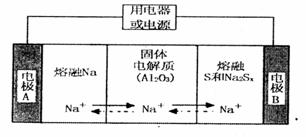
①根据下表数据,请你判断该电池工作的适宜温度应控制在_______。

②放电时,电极A为____极,S发生_______反应。
③放电时,内电路中的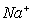 的移动方向为_______(填“从A到B”或“从B到A”)。
的移动方向为_______(填“从A到B”或“从B到A”)。
④充电时,总反应为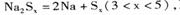 Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
下列化学用语正确的是( )
|
| A. | 氯化钠的电子式:Na: |
|
| B. | 乙烯的结构简式:C2H4 |
|
| C. | 硅的原子结构示意图: |
|
| D. | 硫酸的电离方程式:H2SO4=H22++SO42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K时,实验测得溶液中的反应:H2O2+2HI====2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol·L-1·min-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol·L-1·min-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A.0.038 0 mol·L-1·s-1 B.0.152 mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(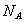 代表阿伏加德罗常数值)
代表阿伏加德罗常数值)
A. 1molNa被完全氧化为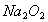 ,失去的电子数为2
,失去的电子数为2
B. 常温常压下,16g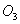 气体含有氧原子数为
气体含有氧原子数为
C. 常温常压下,22.4L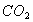 含有的分子数为
含有的分子数为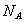
D. 18g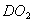 所含的电子数为10
所含的电子数为10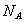
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)====ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,反应物总能量<生成物总能量
B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2
C.101 kPa时,2H2(g)+O2(g)====2H2O(g) ΔH=-483.6 kJ·mol-1, H2的燃烧热为241.8 kJ·mol-1
D.H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1,含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)====2HCl(g) ΔH=-185 kJ·mol-1,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为_________。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
③2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
标准状况下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是__________。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)====CH4(g)的反应热ΔH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C在元素周期表中的位置如图所示。已知B、C两元素所在族数之和是A元素族数的2倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C是 ( )
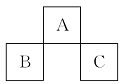
A.Be、Na、Al B.B、Mg、Si
C.O、P、Cl D.C、Al、P
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图装置测定中和热的实验步骤如下:
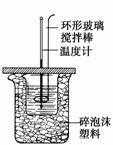
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):________________________________________________________________________
________________________________________________________________________。
(2)倒入NaOH溶液的正确操作是______(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是______(从下列选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温 度t2/℃ | 温度差平均值(t2-t1) /℃ | |
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
②近似认为0.55 mol·L-1 NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=
________________________________________________________________________
( 取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)
____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com