
| A.a的浓度必小于乙酸的浓度 | B.a的浓度必大于乙酸的浓度 |
| C.b的浓度必小于乙酸的浓度 | D.b的浓度与乙酸的浓度无法比较 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.大于7 | B.小于7 | C.等于7 | D.三种都有可能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1︰9 | B.9︰1 | C.1︰11 | D.11︰1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b | B.a=10-4b | C.b =10-4 a | D.a =b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.T℃时,Ba(OH)2溶液中c(H+)·c(OH-)=10-12,向pH=8的该溶液加入等体积pH=4的盐酸,则混合液pH=7 |
| B.pH相等的硫酸、盐酸、醋酸,都稀释1000倍,稀释后pH最大的是醋酸 |
| C.0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液在常温时pH一定小于7 |
| D.在0.1mol/L的硫酸氢铵溶液中各离子浓度关系是:c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中碳酸氢根电离的氢离子浓度为10-10mol·L-1 |
B.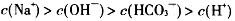 |
| C.溶液中水电离的氢氧根离子浓度为10-4mol·L-1 |
D.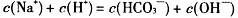 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在铁船闸上装若干铜块以减缓其腐蚀 |
| B.Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
| C.电解精炼铜时,阳极质量每减少32g,阴极析出的铜质量也为32g |
| D.钢铁发生吸氧腐蚀时,Fe作负极,负极反应式为:Fe-3e-=Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com