
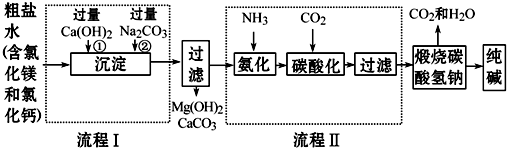
分析 (1)根据流程图分析可得循环物质;
(2)根据除杂过程与反应分析溶质的成分;
(3)氨气溶于水显碱性,有利于二氧化碳的吸收;
(4)根据反应物生成物结合流程写方程;
(5)根据该温度下碳酸氢钠的溶解度比氯化铵小.
解答 解:(1)在流程中能够回收再利用的物质是水和二氧化碳;
故答案为:水、二氧化碳;
(2)过量的氢氧化钙与氧化镁生成氢氧化镁沉淀和氯化钠,过量碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,与氢氧化钙生成碳酸钙沉淀和氢氧化钠,所以滤液的溶质主要有氯化钠、过量的碳酸钠和生成的氢氧化钠;
故答案为:氯化钠、氢氧化钠、碳酸钠;
(3)氨气溶于水显碱性,更有利于吸收二氧化碳;
故答案为:氨气的水溶液是碱性,更易吸收二氧化碳;
(4)根据流程,氯化钠、水、二氧化碳、氨气反应生成碳酸氢钠和氯化铵,所以发生的方程为:NaCl+H2O+NH3+CO2═NaHCO3+NH4Cl;
故答案为:NaCl+H2O+NH3+CO2═NaHCO3+NH4Cl;
(5)工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是在该温度下碳酸氢钠的溶解度比氯化铵小;
故答案为:在该温度下碳酸氢钠的溶解度比氯化铵小.
点评 本题考查了粗盐提纯与侯氏制碱法的综合运用,题目难度不大,注重基础和对课本知识的迁移能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
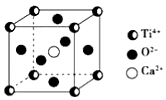 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为136 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.7 | B. | 8.5 | C. | 32 | D. | 64 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过质谱法只能确认化合物的相对分子质量,一般无法确定其结构 | |
| B. | 甲苯分子的核磁共振氢谱中有2个不同的吸收峰 | |
| C. | 红外光谱可以帮助确定许多有机物结构 | |
| D. | 某有机物完全燃烧只生成CO2和H2O,两者的物质的量之比为1:2,则该有机物可能为甲烷或甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| B. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量 Cu(NO3)2溶液 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,降低温度时:v(正)增大,v (逆)减小,平衡时氢气转化率增大 | |
| D. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HS-)+2c(S2-)+c(OH-) | |
| B. | c(H2S)+c(HS-)+c(S2-)=0.1 mol/L | |
| C. | 将上述溶液稀释至0.01 mol/L,c(H+)•c(OH-)不变 | |
| D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积仅适用于纯水 | |
| B. | 水的电离需要直流电 | |
| C. | 升高温度水的离子积增大 | |
| D. | 加入电解质一定会破坏水的电离平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com