
分析 使一定质量的Zn与100ml18.5mol/L的浓硫酸充分反应,Zn完全溶解,同时生成气体33.6L,将生成的气体用过量的NaOH溶液充分吸收后,体积变为26.88L,则气体中含有二氧化硫,剩余的26.88L为氢气,则n(H2)=$\frac{26.88L}{22.4L/mol}$=1.2mol,所以二氧化硫的物质的量为$\frac{33.6L-26.88L}{22.4L/mol}$=0.3mol,根据反应方程式计算.
解答 解:使一定质量的Zn与100ml18.5mol/L的浓硫酸充分反应,Zn完全溶解,同时生成气体33.6L,将生成的气体用过量的NaOH溶液充分吸收后,体积变为26.88L,则气体中含有二氧化硫,剩余的26.88L为氢气,则n(H2)=$\frac{26.88L}{22.4L/mol}$=1.2mol,所以二氧化硫的物质的量为$\frac{33.6L-26.88L}{22.4L/mol}$=0.3mol;
Zn+2H2SO4 =ZnSO4+SO2↑+H2O,
0.3mol 0.6mol 0.3mol
Zn+H2SO4=ZnSO4+H2↑,
1.2mol 1.2mol 1.2mol
(1)由分析可知,反应消耗的锌为0.3mol+1.2mol=1.5mol,其质量为1.5mol×65g/mol=97.5g;
答:参加反应的Zn的质量为97.5g;
(2)由分析可知,反应消耗的硫酸为0.6mol+1.2mol=1.8mol;
答:参加反应的H2SO4的物质的量为1.8mol;
(3)反应后剩余的硫酸为0.1L×18.5mol/L-1.8mol=0.5mol,则所得溶液中H+的物质的量浓度是c(H+)=$\frac{0.5mol×2}{1L}$=1mol/L;
答:所得溶液中H+的物质的量浓度是1mol/L.
点评 本题考查方程式的相关计算,题目难度不大,注意浓硫酸和稀硫酸性质的不同,从质量守恒的角度解答该题,计算生成气体的物质的量关系是解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中元素排序的依据是元素的相对原子质量 | |
| B. | 在金属元素和非金属元素分界线,可以找到半导体材料 | |
| C. | 元素周期表有十六个族,也就有十六个纵行 | |
| D. | 元素周期表已发展成为一个稳定的形式,它不可能再有任何新的变化了 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 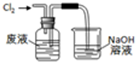 氧化废液中的溴化氢 | B. |  分离CCl4层和水层 | ||
| C. | 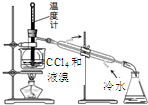 分离四氯化碳和液溴 | D. |  储存液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
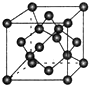 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com