
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
分析 A.盖斯定律实质上是能量守恒定律的体现,反应的热效应只与始态、终态有关,与过程无关;
B.浓硫酸稀释过程中也放出热量,所以放出的热量大于57.3kJ;
C.物质具有的能量越低,该物质越稳定;
D.燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量.
解答 解:A.反应物的始态、终态相同,则物质具有的能量相同,反应过程中能量变化也相同,所以盖斯定律实质上是能量守恒定律的体现,故A正确;
B.浓硫酸稀释过程中会放出热量,导致生成1mol水时放出的热量增大,则测得中和过程中所放出的热量大于57.3kJ,故B正确;
C.由C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,该反应为吸热反应,说明金刚石的能量大于石墨,则石墨比金刚石稳定,故C正确;
D、燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量,氢气的燃烧热化学反应方程式中燃料的计量数是1不能是2,故D错误;
故选D.
点评 本题考查了燃烧热和中和热的概念应用的判断,题目难度不大,注意燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量,中和热不包括酸、碱溶解时所吸收或放出的热量,试题培养了学生的灵活应用能力.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题

| A. | ①中,d极发生氧化反应、c极发生还原反应 | |
| B. | ②中从a口通入气体,可用于收集H2、NH3、CH4等气体 | |
| C. | ③中X若为CCl4,上层为稀硫酸,可用于吸收氨气,并防止倒吸 | |
| D. | ④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
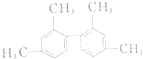
| A. | 等质量的该烃和甲烷均完全燃烧,耗氧量后者小于前者 | |
| B. | 该烃能使酸性高锰酸钾溶液褪色,属于苯的同系物 | |
| C. | 分子中一定有11个碳原子处于同一平面上 | |
| D. | 该烃的一氯取代产物为6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
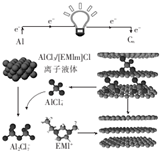 英国《自然》杂质近期报道了一种用泡沫石墨烯(CW)作为正极材料的新型铝离子电池,其放电时的工作原理如图所示,下列说法不正确的是( )
英国《自然》杂质近期报道了一种用泡沫石墨烯(CW)作为正极材料的新型铝离子电池,其放电时的工作原理如图所示,下列说法不正确的是( )| A. | 放电时,若外电路中转移1mol电子,则负极质量减少9g | |
| B. | 充电时,石墨烯作阳极 | |
| C. | 充电时,阴极的电极反应式为AlCl4-+3e-═Al+4Cl- | |
| D. | 放电时,正极的电极反应式为CW(AlCl4)+e-═CW+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向转动 | B. | 平衡不移动 | ||
| C. | C的百分含量增大 | D. | C的百分含量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 使用填埋法处理未经分类的生活垃圾 | 食用油脂能促进人体对某些维生素的吸收 | 利用二氧化碳可制造全降解塑料,有利于缓解温室效应 | 药皂中的少量苯酚,可起到杀菌消毒的作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取并收集少量HCl | B. | 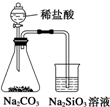 证明非金属性强弱:Cl>C>Si | ||
| C. | 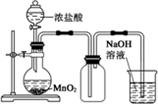 实验室制Cl2 | D. | 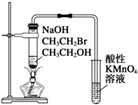 验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com