
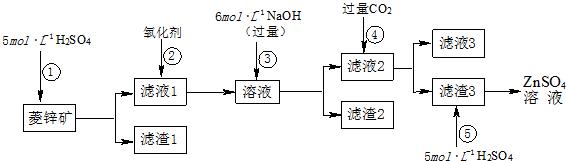

分析 此类流程图题,要先明确目的,围绕“目的”,推测每个步骤中所加试剂的作用,然后结合各物质的性质,推断出各步骤中的物质.要注意按题目要求答题.
(1)根据物质的性质,能溶于酸的在滤液中,不溶于酸的在滤渣中.
(2)根据流程图分析,与碱生成沉淀的是滤渣2
(3)根据Zn(OH)2与Al(OH)3相似,可推断相关方程式,
(4)根据题目信息,Zn与Al相似推断
(5)利用盖斯定律,结合“同侧加,异侧减,系数不同,对应变”,求出目标方程式.
解答 解:根据流程图中各步骤中的部分相关成分分析
菱锌矿成分ZnCO3,SiO2、FeCO3、Cu2(OH)2CO3 ①加硫酸后ZnSO4,SiO2、FeSO4、CuSO4②加入氧化剂二价铁被氧化为三价铁,其他微粒不变③加入过量NaOHFe(OH)3、Cu(OH)2Na2ZnO2④通入过量CO2后反应生成Zn(OH)2NaHCO3
所以滤渣3即为Zn(OH)2加硫酸后生成ZnSO4
(1)根据题目信息,菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3,在流程图中首先加入硫酸,根据物质性质可知,菱锌矿中成分除SiO2都能溶于硫酸,所以滤渣1的化学式为SiO2;因H2O2 的还原产物H2O,不会引入新的杂质,所以选H2O2 作氧化剂.
故答案为:SiO2;B;
(2)根据流程图的成分分析可看出:因Fe(OH)3、Cu(OH)2不溶于水,所以滤渣2的成分是:Fe(OH)3、Cu(OH)2;因步骤①中,硫酸与ZnCO3、FeCO3、Cu2(OH)2CO3 反应时均产生 CO2,所以为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤①;
故答案为:Fe(OH)3、Cu(OH)2;①;
(3)由题目信息知:Zn(OH)2与Al(OH)3相似,则与Na2ZnO2与NaAlO2类似,即Na2ZnO2与过量CO2反应方程式为:Na2ZnO2+2CO2+2H2O=Zn(OH)2↓+2NaHCO3,离子方程式为;ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-
故答案为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-;
(4)Al片和Cu片放入NaOH溶液中形成原电池的负极反应式为:Al-3e-+4OH-=AlO2-+2H2O,由题目信息知,与Al相似,Zn也能溶于NaOH溶液,所以将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式为:Zn-2e-+4OH-=ZnO22-+2H2O
故答案为:Zn-2e-+4OH-=ZnO22-+2H2O;
(5)将题目提供热化学方程式编号如下:①Ba(s)+S(s)+2O2(g)═BaSO4(s)△H1=-1473.2kJ•mol-1
②C(s)+1/2O2(g)═CO(g)△H2=-110.5kJ•mol-1
③Ba(s)+S(s)═BaS(s)△H3=-460kJ•mol-1
根据“同侧加,异侧减,系数不同,对应变”,目标方程式可通过已知方程式进行运算4×②+③-①得到,
所以△H=4×△H2+△H3-△H1=+571.2 kJ•mol-1,故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1;
(6)如果如果Ⅰ中步骤⑤使用硫酸过量,会发生如下反应,BaS+H2SO4=H2S↑+ZnSO4,H2S气体有毒,会污染环境;故答案为:过量的酸与BaS溶液混合会产生有毒的H2S气体污染空气(1分),而且锌钡白的产率会降低.
点评 明确流程图,一定要抓住题目提供的“关键”信息,并根据相关知识,按要求解答.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:多选题
| A. | 控制工业废水的排放 | B. | 控制生活污水的排放 | ||
| C. | 对被污水污染了的河流进行治理 | D. | 减少用水量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为置换反应 | B. | 每生成1mol O2转移4mol e- | ||
| C. | H2O2被还原 | D. | 反应后溶液pH值升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
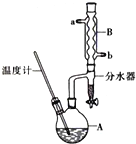 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下| 相对分 子质量 | 沸点/ ℃ | 密度 (g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,属于离子化合物(填“离子化合物”,“共价化合物”)
,属于离子化合物(填“离子化合物”,“共价化合物”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

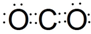 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠跟水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | 碳酸氢钙溶液加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 碳酸氢钠溶液中加入盐酸:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com