
【题目】某无色透明溶液中只可能大量存在NH4+、Na+、Ag+、Ba2+、MnO4-、Fe3+、CO32-、SO42-、NO3-中的几种离子。从其中取两份各100mL,进行如下实验:
(1)不做任何实验就可以肯定原溶液中不存在的两种离子是_______、_______。
(2)取其中的一份进行实验,加入过量氢氧化钠溶液并加热,生成气体0.06mol。另取其中的一份加入过量Ba(NO3)2溶液,生成白色沉淀4.30 g,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33 g。综上所述说明原溶液中肯定存在的各离子浓度分别是(下面填写要求:例如c(Na+)=0.1 mol/L)
_____________、____________、____________、_____________(此空可以不填完)
(3)题干中的MnO4-是化学中的典型强氧化剂,另外生活中常用到的草酸(H2C2O4)是二元弱酸且具有还原性,二者在酸性条件下反应:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+ K2SO4+8H2O,该反应中氧化产物是___________(填名称),请写出该离子方程式并用双线桥标出电子转移的方向与数目:________________________________________________________。
【答案】MnO4- Fe3+ c(NH4+)=0.6 mol/L c(SO42-)=0.1 mol/L c(CO32-)=0.1 mol/L c(NO3-)≥0.2 mol/L 二氧化碳 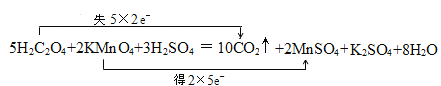
【解析】
(1)无色透明溶液中不能大量存在有色离子;
(2)分析原溶液中可能存在的离子,并结合关系式及元素守恒定量分析各离子的物质的量大小,进而得出相应的浓度大小;最后利用电荷守恒推出溶液中所含硝酸根离子浓度的范围;
(3)根据氧化还原规律作答,化合价升高,被氧化得到的产物是氧化产物;根据化学方程式结合电子转移情况利用双线桥法分析作答。
(1)MnO4-在溶液中显紫色,Fe3+在溶液中显黄色,题设条件为无色透明溶液,则肯定原溶液中不存在的两种离子是MnO4-、Fe3+,
故答案为:MnO4-;Fe3+;
(2)加入过量氢氧化钠溶液并加热,生成的气体为氨气,则n(NH3)=0.06mol,根据关系式可知,原溶液中的铵根离子的物质的量n(NH4+) = n(NH3)=0.06 mol,所以c(NH4+)=![]() = 0.6 mol/L;取其中的一份加入过量Ba(NO3)2,生成白色沉淀4.30g,是碳酸钡和硫酸钡的混合物,一定含有CO32-、SO42-,一定不含H+、Ag+、Ba2+。经过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33g,因碳酸钡溶于盐酸但是硫酸钡不溶,所以余下沉淀2.33g是硫酸钡,其物质的量是
= 0.6 mol/L;取其中的一份加入过量Ba(NO3)2,生成白色沉淀4.30g,是碳酸钡和硫酸钡的混合物,一定含有CO32-、SO42-,一定不含H+、Ag+、Ba2+。经过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33g,因碳酸钡溶于盐酸但是硫酸钡不溶,所以余下沉淀2.33g是硫酸钡,其物质的量是![]() = 0.01 mol,即原溶液中含有硫酸根离子是0.01 mol,c(SO42-)=
= 0.01 mol,即原溶液中含有硫酸根离子是0.01 mol,c(SO42-)=![]() = 0.1 mol/L;碳酸钡的质量则是4.30g2.33g=1.97g,故碳酸根物质的量为
= 0.1 mol/L;碳酸钡的质量则是4.30g2.33g=1.97g,故碳酸根物质的量为![]() = 0.01 mol,所以c(CO32-) =
= 0.01 mol,所以c(CO32-) = ![]() = 0.1 mol/L;根据电荷守恒可知溶液中必定还存在NO3,n(NO3)(0.060.01×2+0.01×2)= 0.02 mol,其浓度c(NO3)
= 0.1 mol/L;根据电荷守恒可知溶液中必定还存在NO3,n(NO3)(0.060.01×2+0.01×2)= 0.02 mol,其浓度c(NO3)![]() = 0.2 mol/L,
= 0.2 mol/L,
故答案为:c(NH4+)=0.6 mol/L;c(SO42-)=0.1 mol/L;c(CO32-)=0.1 mol/L;c(NO3-)≥0.2 mol/L;
(3)在反应5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+ K2SO4+8H2O中,C元素由+3价升高为+4价,对应的产物二氧化碳为氧化产物,Mn元素由|+7价降低为+2价, 5×2则双线桥标出反应电子转移的方向和数目如下: ,
,
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】25℃时,有下列四种溶液,下列说法正确的是
① | ② | ③ | ④ |
0.1mol/L的氨水 | pH=11的氨水 | 0.1mol/L的盐酸 | pH=3的盐酸 |
A.①稀释到原来的100倍后,pH与②相同
B.等体积①③混合、等体积②④混合所得的溶液都成酸性
C.①②中分别加入少量CH3COONa固体,![]() 的值变小
的值变小
D.将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则c(NH4+)>c(Cl-)> c(NH3H2O)> c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法测定13.6g有机物A完全燃烧只生成35.2gCO2和7.2gH20。A的蒸气与氢气的相对密度为68,红外光谱图确定A结构中含有苯环。
(1)A的分子式为____________。
(2)若实验证明有机物A能够与碳酸氢钠溶液反应产生气体,苯环上的一氯取代物只有两种。则A的结构简式为____________。
(3)若实验证明有机物A能够在酸或碱性条件下发生水解反应生成CH30H,则A的化学名称为____________。
(4)若实验证明有机物A①能够发生银镜反应;②遇FeC13溶液不发生显色反应;③可以与金属钠反应产生H2,则A的同分异构体有____种。
(5)有机物A有如下转化关系:
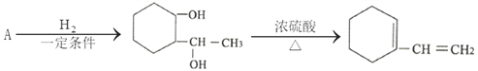
则A分子中含氧官能团的名称为____________,A的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题:
(1)海水是一个巨大的资源宝库,海水开发利用制取Cl2的离子方程式:____________。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:____________。
(3)除去Na2CO3粉末中混入的NaHCO3杂质最佳方法是_________,化学方程式为___________。
(4)除去CO2气体中混入的HCl气体杂质,需将气体通入_________中,其离子方程式为______。
(5)生活中通常用二氧化碳做灭火剂,但镁条着火不能用二氧化碳灭火,其相关原因的化学方程式是: ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别只用一种试剂除去下列各组中所含的少量杂质(括号内为杂质),在空格中填上需加入的一种试剂:
(1)FeCl3溶液(FeCl2)________________。
(2)FeCl2溶液(FeCl3)________________。
(3)Fe 粉末(Al) _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,在纺织、造纸、化工合成方面都有重要的用途。
(1)工业上电解饱和食盐水制取氯气:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为___L。工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式___________
2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为___L。工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式___________
(2)实验室用常用MnO2与浓盐酸共热制氯气,试写出该反应的化学方程式_____________________,若用100mL12mol·L-1的浓盐酸与足量的MnO2反应,则生成的氯气在标准状况下的体积_____6.72L(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g) ![]() H2S(g)+CO(g) △H=+7kJ/mol。
H2S(g)+CO(g) △H=+7kJ/mol。
已知:2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol。
写出表示CO燃烧热的热化学方程式:______________。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率____(填“增大”“减小”或“不变”,下同),COS的转化率_______。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5min内,v(H2S)=_______mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用如下图装置制备氢氧化亚铁并观察其颜色。

提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
(1)稀硫酸应放在_____________中(填写仪器名称)。
(2)本实验通过控制A、B、C三个开关,可将仪器中的空气排尽,具体操作为:关闭开关_______,打开开关________,打开分液漏斗活塞;待反应一段时间排尽空气后,再关闭开关_______,打开开关_______,就可观察到氢氧化亚铁的颜色。试分析实验开始时需排尽装置中空气的理由_______________________________(用化学反应方程式作答)。
(3)某同学认为本实验中应该用铁钉代替铁粉,他的理由是________________________。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①从摩尔盐水溶液中提取 (NH4)2SO4·FeSO4·6H2O晶体的具体操作是______________,用乙醇洗涤,干燥。
②为了测定产品的纯度,称取10 g产品溶于50 mL水中,配制成250 mL溶液,用浓度为0.01 mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00 mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
通过实验数据计算的该产品纯度为________,上表中第一次实验中记录数据明显大于后两次,其原因可能是________。
A.第一次滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.第一次实验结束时俯视刻度线读取酸性高锰酸钾溶液的体积
C.第一次滴定用的锥形瓶用待测液润洗过
D.第一次实验装高锰酸钾的滴定管清洗后没有润洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com